分子轨道
(重定向自分子軌域)
此条目可参照英语维基百科相应条目来扩充。 |
分子轨道(英语:Molecular orbital, MO)是化学中用以描述分子中电子的波动特性的函数。这个函数可以计算出化学和物理性质,例如在任意一个特定区域找到电子的概率。“轨道”一词由罗伯特·桑德森·马利肯于1932年提出,为“单电子轨道波函数”(one-electron orbital wave function)的简称。[1]从基本层面上来说,它用于描述该函数具有显著振幅的空间区域。分子轨道通常由分子中的个别原子提供的原子轨道、杂化轨道,或者其他原子团的分子轨道结合而成。这些可以由哈特里-福克方程或自洽场方法(SCF)量化计算。

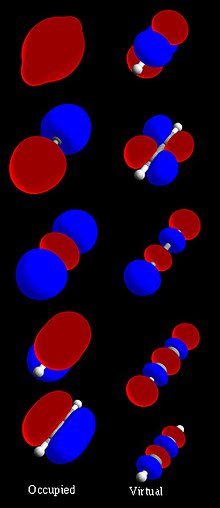
分子轨道可以用来表示分子中占有该轨道的电子可能出现的区域。分子轨道由原子轨道结合而成,其中原子轨道预测了原子中电子的位置。分子轨道可以具体说明分子的电子排布:一个或一对电子的空间分布和它(们)的能量。分子轨道通常会以原子轨道线性组合(LCAO-MO法)表示,尤其是在进行定性或近似分析的时候。它们的宝贵之处在于对分子键结提供了简单的模型,使之能透过分子轨道理论了解。现今大多数用于计算化学的方法由计算系统的MO开始。分子轨道描述一个电子在原子核产生的电场中的表现,以及与其他电子的平均分布。根据泡利不相容原理,两个电子占据相同轨道时,必须具有相反的自旋。这注定只是一个近似值,能够高度精准描述的分子电子波函数并没有轨道(参:排布相互作用方法)。
参见
编辑参考资料
编辑- ^ Mulliken, Robert S. Electronic Structures of Polyatomic Molecules and Valence. II. General Considerations. Physical Review. July 1932, 41 (1): 49–71. Bibcode:1932PhRv...41...49M. doi:10.1103/PhysRev.41.49.
外部链接
编辑- Real-Time Visualization of the Quantum Mechanical Atomic Orbitals (页面存档备份,存于互联网档案馆) (英文)
- Molecular Orbital Viewer (页面存档备份,存于互联网档案馆) (英文)
- The Orbitron:a gallery of atomic orbitals and molecular orbitals on the WWW (页面存档备份,存于互联网档案馆) (英文)
- xeo (页面存档备份,存于互联网档案馆) Visualizations of some atomic and molecular atoms (英文)