玻尔模型
玻尔模型是丹麦物理学家尼尔斯·玻尔于1913年提出的关于原子结构的模型。此模型引入量子化的概念来研究原子内电子的运动,对于计算氢原子光谱的里德伯公式给出了理论解释。玻尔模型是20世纪初期物理学取得的重要成就,对原子物理学产生了深远的影响。
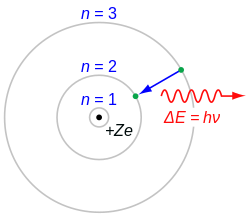
玻尔模型的提出
编辑20世纪初期,德国物理学家普朗克为解释黑体辐射现象,提出能量量子化假说,揭开了量子理论的序幕。[2]:58-631885年,瑞士数学教师巴耳末将氢原子的谱线表示成巴耳末公式。然而巴耳末公式是经验公式,直到玻尔在1913年提出玻尔模型为止,人们并不了解它们的物理含义。[3]:143
1911年,英国物理学家卢瑟福根据1909年开始进行的α粒子散射实验,提出了原子的卢瑟福模型。在这个模型里,原子的中心有一个带正电(Ze)、带质量的原子核,在原子核的四周是带负电的电子云;其中,Z是原子数,e是单位电荷。从卢瑟福模型,卢瑟福推导出散射公式,其预测与实验结果相符合。然而,在卢瑟福散射实验里,主角是原子核,而电子并不重要,因此卢瑟福不能空口无凭地给出电子的排列方式,也无法用这模型对于化学结合、元素列表、原子谱线给出解释。[4][2]:51-53
1912年,正在英国曼彻斯特大学工作的玻尔将一份被后人称作《曼彻斯特备忘录》的草稿提交给他的导师卢瑟福。在这份直到玻尔过世后才被发布的草稿中,玻尔在卢瑟福模型的基础上引入了普朗克的量子概念,玻尔提议,原子可以维持力学稳定性,[注 1]前提是电子的动能 与电子环绕原子核的公转频率 ,两者之间的关系式假定为
- ;
其中, 与普朗克常数有关。
注意到他并没有确切给出 的形式,也没有将辐射稳定性纳入考量,[注 2]更没有理论证实他的假定可以达成力学稳定性。[2]:54[3]:135-139
1913年2月4日前后的某一天,玻尔与同事汉斯·汉森讨论他的研究,汉森提问:“这研究与谱线方程有什么关系?”玻尔回答说他会去查阅这方面的资料。玻尔博览那时期的科学文献,而且巴耳末公式在科学文献里是常被引述的谱线方程,很可能他已看到过这公式,但并没有注意到这公式与自己研究有什么的关联,而且已完全忘掉这公式。不论如何,他详细阅读了约翰内斯·斯塔克撰写的教科书(德文)有关谱线方面的内容,特别是关于巴耳末公式的描述,后来他回忆:“就在我看到巴耳末公式的那一瞬间,突然一切都变得清楚了。”[注 3]3月7日,他写好一篇诠释巴耳末公式的论文,其开启了原子结构的量子理论。[3]:144[5]:43
1913年7月、9月、11月,《哲学杂志》接连刊载了玻尔的三篇论文,[6][7][8]标志着玻尔模型正式提出。这三篇论文成为物理学史上的经典,被称为玻尔模型的“三部曲”。[5]:7他在第一篇论文中利用玻尔模型分析了氢原子,在第二篇论文中论述了其它原子结构与周期表,在第三篇论文中探讨了分子结构。[3]:149
玻尔模型的主要内容
编辑玻尔模型的两个主要假设为,[9]:1097-1100
轨道半径量子化
编辑按照第一个假设,在氢原子中的电子,围绕著原子核做圆周运动,其轨道是经典轨道。电子做圆周运动的向心力是由电子和原子核之间的库仑力所提供:[9]:1097-1100
- ,
其中, 是电子质量, 是电子速率, 是电子轨道半径, 是电常数, 是基本电荷。
所以,半径为
- ,
另外,圆周运动的角动量大小是半径乘以动量:
- 。
所以,按照第二个假设,速度为
- ,
将速度的表达式代入半径的表达式,可以得到新的半径的表达式
- 。
这轨道半径表达式可以重写为
- ;
其中, 是玻尔半径。
在氢原子的波尔模型里,以原子核为圆心的电子圆周运动的半径被量子化,最小的半径是玻尔半径。由于电子被禁止离原子核更近,库仑力无法将电子吸引到原子核里,电子也不会因为进行圆周运动的加速度而释出电磁波。
轨道能量量子化
编辑电子绕着原子核的轨道能量 是动能 加势能 :[9]:1097-1100
- 。
将轨道半径表达式代入轨道能量表达式,可以得到
- 。
在氢原子的波尔模型里,轨道能量被量子化,并与主量子数的平方成反比。这是束缚电子的能量。由于原子核被假设为固定不动,这能量也可以视为整个氢原子的能量。
跃迁能量变化
编辑电子只能够稳定地存在于一系列的离散的能量状态之中,称为定态。假若电子的能量发生任何变化,都必须要在两个定态之间以跃迁的方式进行,所以电子只能处于一系列分立的定态。当电子从一个定态跃迁至另一个定态时,会以电磁波的形式放出或吸收能量:[9]:1097-1100
- ,
其中, 是电磁波的频率。
将轨道能量表达式代入这公式,可以得到
- 。
将这表达式重写,可以得到里德伯公式:
- 。
其中, 是里德伯常数。
修正
编辑英国光谱学家亚弗列德·福勒质疑:应用玻尔模型计算出里德伯常数的数值 ;而实验值 ,二者相差大约万分之五。1914年,玻尔提出,这是因为原来的模型假设原子核静止不动而引起的。实际情况是,原子核的质量不是无穷大,它与电子绕共同的质心转动。玻尔对其理论进行了修正,用原子核和电子的约化质量 代替了电子质量。这样的话,不同原子的里德伯常数RA不同,
电子到质心的距离仍为原来理论中的第一轨道半径,与原子核的质量无关。
玻尔模型的实验验证
编辑1897年,美国天文学家爱德华·皮克林在恒星弧矢增二十二的光谱中发现了一组独特的线系,称为皮克林线系。皮克林线系中有一些谱线靠近巴耳末线系,但又不完全重合,另外有一些谱线位于巴耳末线系两临近谱线之间。起初皮克林线系被认为是氢的谱线,然而玻尔提出皮克林线系是类氢离子He+发出的谱线。随后英国物理学家埃万斯在实验室中观察了He+的光谱,证实玻尔的判断完全正确。
和玻尔提出玻尔模型几乎同一时期,英国物理学家亨利·莫塞莱测定了多种元素的X射线标识谱线,发现它们具有确定的规律性,并得到了经验公式——莫塞莱定律。莫塞莱看到玻尔的论文,立刻发现这个经验公式可以由玻尔模型导出,为玻尔模型提供了有力的证据。
1914年,詹姆斯·弗兰克和古斯塔夫·赫兹进行了用电子轰击汞蒸汽的实验,即弗兰克-赫兹实验。实验结果显示,汞原子内确实存在能量为4.9eV的量子态。1920年代,弗兰克和赫兹又继续改进实验装置,发现了汞原子内部更多的量子态,有力地证实了玻尔模型的正确性。
玻尔模型的推广
编辑随着光谱实验水平的提高,人们发现了光谱具有精细结构。1896年,阿尔伯特·迈克耳孙和爱德华·莫雷观察到了氢光谱的Hα线是双线,随后又发现是三线。玻尔提出这可能是电子在椭圆轨道上做慢进动引起的。1916年索末菲在玻尔模型的基础上将圆轨道推广为椭圆形轨道,并且引入相对论修正,提出了索末菲模型。在考虑椭圆轨道和相对论修正后,索末菲计算出了Hα线的精细结构,与实验相符。然而进一步的研究发现,这样的解释纯属巧合。Hα线的精细结构有7条,必须彻底抛弃电子轨道的概念才能完全解释光谱的精细结构。
玻尔模型的问题
编辑玻尔模型将经典力学的规律应用于微观的电子,不可避免地存在一系列问题。根据经典电动力学,做加速运动的电子会辐射出电磁波,致使能量不断损失,而玻尔模型无法解释为什么处于定态中的电子不发出电磁辐射。玻尔模型对跃迁的过程描写含糊。因此玻尔模型提出后并不被物理学界所欢迎,还遭到了包括卢瑟福、薛定谔在内的诸多物理学家的质疑。玻尔曾经的导师、剑桥大学的约瑟夫·汤姆孙拒绝对其发表评论。薛定谔甚至评价说是“糟透的跃迁”[10]。
此外,玻尔模型无法揭示氢原子光谱的强度和精细结构,也无法解释稍微复杂一些的氦原子的光谱,以及更复杂原子的光谱。因此,玻尔在领取1922年诺贝尔物理学奖时称:“这一理论还是十分初步的,许多基本问题还有待解决。”
玻尔模型引入了量子化的条件,但它仍然是一个“半经典半量子”的模型。完全解决原子光谱的问题必须彻底抛弃经典的轨道概念。尽管玻尔模型遇到了诸多困难,然而它显示出量子假说的生命力,为经典物理学矢量子物理学发展铺平了道路。
参阅
编辑注释
编辑参考文献
编辑- ^ Lakhtakia, Akhlesh; Salpeter, Edwin E. Models and Modelers of Hydrogen. American Journal of Physics. 1996, 65 (9): 933. Bibcode:1997AmJPh..65..933L. doi:10.1119/1.18691.
- ^ 2.0 2.1 2.2 Kragh, Helge. Quantum Generations: A History of Physics in the Twentieth Century Reprint. Princeton University Press. 2002. ISBN 978-0691095523.
- ^ 3.0 3.1 3.2 3.3 Pais, Abraham. Niels Bohr's Times, In Physics, Philosophy and Polity. Oxford: Clarendon Press. 1991. ISBN 978-0-19-852049-8 (英语).
- ^ 卢瑟福, 欧内斯特, The Scattering of α and β Particles by Matter and the Structure of the Atom, Philosophical Magazine, May 1911, 21: p. 669–688, doi:10.1080/14786440508637080
- ^ 5.0 5.1 5.2 French, A. P.; Kennedy, P. J. (编). Niels Bohr: A Centenary Volume. Cambridge, Massachusetts: Harvard University Press. ISBN 978-0-674-62415-3 (英语).
- ^ Bohr, Niels. On the Constitution of Atoms and Molecules, Part I (PDF). Philosophical Magazine. 1913a, 26 (151): 1–24 [2019-05-27]. doi:10.1080/14786441308634955. (原始内容存档 (PDF)于2019-04-04) (英语).
- ^ Bohr, Niels. On the Constitution of Atoms and Molecules, Part II Systems Containing Only a Single Nucleus (PDF). Philosophical Magazine. 1913b, 26 (153): 476–502 [2019-05-27]. doi:10.1080/14786441308634993. (原始内容存档 (PDF)于2017-12-15) (英语).
- ^ Bohr, Niels. On the Constitution of Atoms and Molecules, Part III Systems containing several nuclei. Philosophical Magazine. 1913c, 26 (155): 857–875. doi:10.1080/14786441308635031 (英语).
- ^ 9.0 9.1 9.2 9.3 Halliday, David; Resnick, Robert; Walker, Jerl, Fundamental of Physics 7th, USA: John Wiley and Sons, Inc., 2005, ISBN 0-471-23231-9
- ^ W.Heisenberg. Physics & Beyond. Harper & Row Pub. (1972)75.