周期性趋势
在化学中,周期性趋势是指元素周期表排布上存在的特定模式,用于显现某些元素按周期或族分组时的差异性。这种模式是由俄国化学家德米特里·门捷列夫于1863年发现的。主要的周期性趋势包括原子半径、电离能、电子亲和力、电负性、价数和金属性。这些趋势的存在是因为元素在各自的族或周期内具有相似的电子排布,反映了元素的周期性。此外周期性趋势对每种元素的性质给予了定性评估[1][2]。
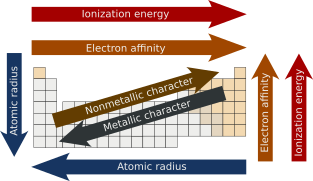
趋势规律
编辑| 周期性质 | 周期趋势 | 族趋势 |
|---|---|---|
| 原子半径 | 减少 | 增加 |
| 金属性 | ||
| 核电荷 | 增加 | |
| 电离能 | 减少 | |
| 电子亲和能 | ||
| 电负性 | ||
| 非金属性 | ||
| 化合价 | 不变 |
原子半径
编辑原子半径是原子核到原子最外层电子轨道的距离。一般来说,原子半径在一个周期中由左至右逐渐减小,在一个族内从上到下依次增大。这是因为一个周期里元素的价电子均位于相同壳层,原子序数在相同的周期内从左向右逐次变大,增加了有效核电荷,吸引力的增加减小了元素的原子半径。依各族从上至下观察时,由于增加了新的壳层,原子半径会增加[3][4]。
电离能
编辑电离能是气态原子或离子中的电子摆脱原子核吸引力影响所必须吸收的最小能量,也被称为电离电位。第一电离能是指从中性原子中去除第一个电子所需的能量,而从该原子中去除第二个电子所需的能量被称为第二电离能,依此类推[5]。
在现代元素周期表的一个周期中,从左向右观察,电离能随着核电荷的增加和原子半径的减小而增加,这是由于原子尺寸的减小导致电子和原子核之间的相互作用力更强。若以一组为单位从上向下观察,由于增加了价电子层,原子半径增加,电离能随之降低,从而减少了原子核对电子的吸引力[6][7]。
电子亲和能
编辑电子被添加到中性气体原子形成阴离子时释放的能量称为电子亲和能[8]。沿一个周期从左至右观察趋势,电子亲和能随着核电荷的增加和原子尺寸的减小而增加,导致原子核和新加入电子之间的吸引力更强。根据族寻找规律时,由于增加了价壳层,电子亲和能会随着原子尺寸的增加而降低,从而削弱原子核对电子的吸引力。尽管理论上氟应该具有最大的电子亲和能,但其过小的尺寸使电子间产生了足够的排斥力,导致氯在卤族元素中具有最高的电子亲和能[9]。
电负性
编辑分子中原子吸引共价键电子的趋势称为电负性,这是一种无量纲属性,因为其仅作为一种趋势存在[10]。 最常用以测量电负性的标度是由美国化学家莱纳斯·鲍林发明的鲍林标度。根据该量表,氟的电负性最强,而铯则为电负性最弱的元素[11]。
沿周期从左向右观察,电负性会随着核电荷增加和原子尺寸的减小而增加,而沿某一族向下移动时,因为增加了价壳层,原子尺寸增加,电负性相应降低,从而减少原子对电子的吸引力[12]。
然而在第十三族(硼族)元素中,电负性首先从硼到铝逐渐减小,然后沿该族向下增加。这是因为更下层元素的原子直径会增加,但同时由于内层d和f轨道电子的屏蔽效应较差,有效核电荷也会增加。结果就是原子核对电子的吸引力增大,因此从铝到铊电负性增大[13][14]。
化合价
编辑一个元素的价数是指为了获得稳定的电子结构,原子必须失去或获得的电子数。简单来说,它是对元素形成化合物结合能力的一种量度。最外层的电子通常称为价电子,价电子的数量决定了原子的价数[15][16]。
从趋势上而言,顺着一个周期从左向右观察,元素的价电子数量从1到8逐渐增加。但是元素的价数先从1增长到4,然后在到达稀有元素一族时降低至0。沿一个族向下移动时,价电子的数量通常不会改变。因此在多数情况下,特定组的元素具有相同的价数。然而,对于较重的元素,特别是f区元素和过渡金属,并不总是遵循这种周期性规律。这些元素表现出可变的价态,因为具有d轨道作为倒数第二和s轨道作为最外层轨道,其(n-1)d和ns轨道(例如4d和5s)的能量比较接近[17][18]。
金属性与非金属性
编辑一般来说,金属元素在本族中的位置愈靠下,其金属性愈强,因为原子核和最外层电子间吸引力的减小削弱了前者对电子的束缚,从而能够传导热和电。在每个周期中,从左到右原子核和最外层电子间的吸引力因为核电荷的增加不断增强,导致金属性下降。反之,非金属性在各族中随所处位置的降低而降低,在各周期中依序逐次增加[19][20]。
参见
编辑参考资料
编辑- ^ The Periodic Table I. Structure and Bonding 181. 2019 [2024-09-22]. ISBN 978-3-030-40024-8. doi:10.1007/978-3-030-40025-5. (原始内容存档于2023-12-04) (英语).
- ^ Schrobilgen, Gary J., Mingos, D. Michael P. , 编, Chemistry at the Edge of the Periodic Table: The Importance of Periodic Trends on the Discovery of the Noble Gases and the Development of Noble-Gas Chemistry, The Periodic Table I: Historical Development and Essential Features, Structure and Bonding (Cham: Springer International Publishing), 2019: 157–196 [2022-07-02], ISBN 978-3-030-40025-5, doi:10.1007/430_2019_49 (英语)
- ^ atomic and ionic radius. www.chemguide.co.uk. [2022-06-30]. (原始内容存档于2020-11-14).
- ^ Huggins, Maurice L. Atomic Radii. I. Physical Review. 1922-04-01, 19 (4): 346–353. doi:10.1103/PhysRev.19.346.
- ^ 7.4: Ionization Energy. Chemistry LibreTexts. 2014-11-18 [2022-07-02]. (原始内容存档于2024-07-25) (英语).
- ^ Ionization Energy Trend | Science Trends. sciencetrends.com. 2018-05-18 [2022-07-02] (美国英语).
- ^ Zadeh, Dariush H. Atomic shells according to ionization energies. Journal of Molecular Modeling. 2019-07-26, 25 (8): 251. ISSN 0948-5023. PMID 31346734. S2CID 198913558. doi:10.1007/s00894-019-4112-6 (英语).
- ^ Gooch, Jan W. (编), Electron affinity, Encyclopedic Dictionary of Polymers (New York, NY: Springer), 2007: 350 [2022-07-02], ISBN 978-0-387-30160-0, doi:10.1007/978-0-387-30160-0_4245 (英语)
- ^ Electron Affinity Trend | Science Trends. sciencetrends.com. 2018-05-14 [2022-07-02] (美国英语).
- ^ Chemistry (IUPAC), The International Union of Pure and Applied. IUPAC - electronegativity (E01990). goldbook.iupac.org. [2022-06-30]. doi:10.1351/goldbook.e01990 . (原始内容存档于2023-07-09).
- ^ Bickmore, Barry R.; Wander, Matthew C. F., White, William M. , 编, Electronegativity, Cham: Springer International Publishing: 442–444, 2018 [2022-06-30], ISBN 978-3-319-39312-4, doi:10.1007/978-3-319-39312-4_222 (英语)
- ^ Mullay, John, Sen, Kali Das; Jørgensen, C. K. , 编, Estimation of atomic and group electronegativities, Electronegativity, Structure and Bonding (Berlin/Heidelberg: Springer-Verlag), 1987, 66: 1–25 [2022-06-30], ISBN 978-3-540-17740-1, doi:10.1007/bfb0029834 (英语)
- ^ 21.1: The Elements of Group 13. Libretexts. 2013-11-26 [2022-06-30]. (原始内容存档于2024-06-16) (英语).
- ^ Franz, Daniel; Inoue, Shigeyoshi. Advances in the development of complexes that contain a group 13 element chalcogen multiple bond. Dalton Transactions. 2016, 45 (23): 9385–9397. ISSN 1477-9226. PMID 27216700. doi:10.1039/C6DT01413E (英语).
- ^ Manutchehr-Danai, Mohsen (编), valency, Dictionary of Gems and Gemology (Berlin, Heidelberg: Springer), 2009: 899 [2022-07-02], ISBN 978-3-540-72816-0, doi:10.1007/978-3-540-72816-0_22746 (英语)
- ^ Vohr, Hans-Werner (编), Valency, Berlin, Heidelberg: Springer: 947, 2016 [2022-07-02], ISBN 978-3-642-54596-2, doi:10.1007/978-3-642-54596-2_201542 (英语)
- ^ Valency. Heidelberg Science Library. 1978 [2024-09-22]. ISBN 978-0-387-90268-5. doi:10.1007/978-1-4612-6262-6. (原始内容存档于2023-02-20) (英语).
- ^ O’Dwyer, M. F.; Kent, J. E.; Brown, R. D., O’Dwyer, M. F.; Kent, J. E.; Brown, R. D. , 编, Many-electron Atoms, Valency (New York, NY: Springer), 1978: 59–86 [2022-07-02], ISBN 978-1-4612-6262-6, doi:10.1007/978-1-4612-6262-6_4 (英语)
- ^ Daw, Murray S.; Foiles, Stephen M.; Baskes, Michael I. The embedded-atom method: a review of theory and applications. Materials Science Reports. 1993-03-01, 9 (7): 251–310. ISSN 0920-2307. doi:10.1016/0920-2307(93)90001-U (英语).
- ^ C9.1 – Periodic Trends. IGCSE AID. 2018-03-05 [2022-07-02]. (原始内容存档于2023-12-04) (英语).