锌铜电池
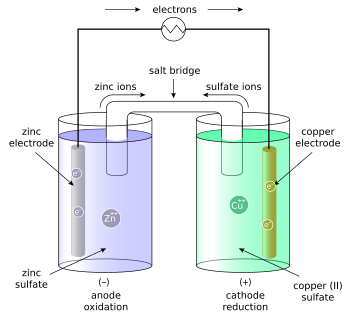
锌铜电池,又称丹尼尔电池(锌铜电池),是一种以(锌)为负电极;(铜)为正电极;硫酸锌与硫酸铜为电解液的电化电池[1],由约翰·弗雷德里克·丹尼尔(John Frederic Daniell)于1836年发明,丹尼尔电池一称来自其发明者的名字,丹尼尔为了消除伏打电堆中出现氢气泡的问题,他的解决方法是使用第二种电解液来消耗只有一种电解液时会产生的氢气。


热力学理论
编辑在热力学里,电动势 乘以电荷量 ,就是分离电荷所做的功项目。对于可逆过程,当电动势促使电荷在电池内移动时,内能的变化包括这项目:
- ;
假设电池为丹尼尔电池,由于在这种电池内进行的反应不会产生气体,系统体积不变,方程式简化为
- 。
让熵 为 和 的函数,熵的全微分为
- 。
假设等温过程,那么,方程式右手边的第一个项目等于零:
- 。
将这方程式带入内能的方程式:
- 。
这方程式右手边的第二个项目是“充电热”(heat of charging),定义为在一个等温可逆的充电过程,系统的热能吸收率 :
- 。
吸收率 比较不容易计算,可以找更有用的变数替换。思考亥姆霍兹自由能 :
- 。
所以, 是一对共轭变量(Conjugate variables)。其马克士威关系式为:
- 。
带入内能的方程式:
- 。
通常,电动势跟温度 、电荷量 有关。假若,能够使丹尼尔电池内的溶液保持饱和状态,有很多离子化合物随时准备分解进入溶液,则电动势跟电荷量无关,只跟温度有关:
- 。
对于丹尼尔电池,体积不变,假设等压过程,则焓的改变 ,称为“反应热”,等于内能的改变:
- 。
- ;
其中, 是金属离子的电价, 是亚佛加厥常数, 是基本电荷量。
假设恒压、恒体积,则电池的热力学性质与电动势的紧密关系,以方程式表达为
- 。
这样,只要得到电动势与温度之间关系的资料,从测量电动势和温度的数据,很容易就能够准确地计算出某化学反应的反应热[3]。
参看
编辑参考文献
编辑- ^ Daniell Cell. [2017-03-22]. (原始内容存档于2021-04-20).
- ^ 可逆电池及其电动势的测定[永久失效链接]
- ^ Colin B P Finn. Thermal Physics. CRC Press. 1992: 163. ISBN 0748743790.
