克诺尔喹啉合成
(重定向自Knorr喹啉合成)
克诺尔喹啉合成(Knorr quinoline synthesis),由德国化学家路德维希·克诺尔(Ludwig Knorr,1859-1921)1886年首先报道。[1]
| Knorr quinoline synthesis | |
|---|---|
| 命名根据 | Ludwig Knorr |
| 反应类型 | 成环反应 |
| 标识 | |
| RSC序号 | RXNO:0000394 |

此反应是亲电芳香取代反应,总过程消除一分子水。
1964年Staskun研究发现在特定条件下4-羟基喹啉是反应的副产物。[2]例如,苯甲酰基乙酰苯胺(1)在远过量的多聚磷酸催化下生成的产物是2-羟基喹啉(2),不过如果用少量的多聚磷酸催化,则会生成4-羟基喹啉(3)。Staskun提出如下N,O-双正离子和 N-正离子中间体以解释这两个产物在不同酸性条件下的生成。

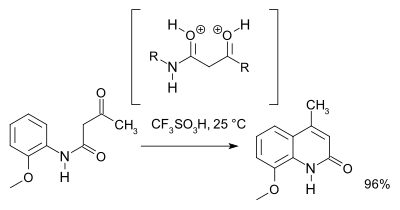
2007年克隆普等利用理论计算和核磁共振谱结果,提出超亲电性的O,O-二正离子中间体在反应条件下比N,O-二正离子更容易生成。而且他们还发现质子酸性的三氟甲磺酸是此反应最有效的酸催化剂。[3]
参见
编辑参考资料
编辑- ^ Ludwig Knorr. Synthetische Versuche mit dem Acetessigester. Justus Liebig's Annalen der Chemie. 1886, 236 (1-2): 69–115. doi:10.1002/jlac.18862360105.
- ^ B. Staskun. The Conversion of Benzoylacetanilides into 2- and 4-Hydroxyquinolines. J. Org. Chem. 1964, 29 (5): 1153–1157. doi:10.1021/jo01028a038.
- ^ Kiran Kumar Solingapuram Sai, Thomas M. Gilbert, and Douglas A. Klumpp. Knorr Cyclizations and Distonic Superelectrophiles. J. Org. Chem. 2007, 72: 9761–9764. doi:10.1021/jo7013092.