氟化氢
此条目需要补充更多来源。 (2021年3月19日) |
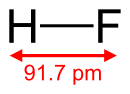
氟化氢(化学式:)是氢的氟化物,有强烈的腐蚀性,有剧毒。它是无色的气体,在空气中,只要超过3ppm就会产生刺激的味道。
| 氟化氢 | |
|---|---|
| |

| |
| IUPAC名 Hydrogen fluoride | |
| 识别 | |
| CAS号 | 7664-39-3 |
| ChemSpider | 14214 |
| SMILES |
|
| InChI |
|
| InChIKey | KRHYYFGTRYWZRS-UHFFFAOYAC |
| ChEBI | 29228 |
| RTECS | MW7875000 |
| KEGG | C16487 |
| 性质 | |
| 化学式 | HF |
| 摩尔质量 | 20.0063 g·mol⁻¹ |
| 外观 | 无色气体 |
| 密度 | 0.818 g/L |
| 熔点 | −83.38 C (189.77 K) |
| 沸点 | 19.54 °C (293.15 K) |
| pKa | 3.17(水) 15(DMSO)[1] |
| 危险性 | |
| 欧盟危险性符号 | |
| 警示术语 | R:R26/27/28-R35 |
| 安全术语 | S:S1/2-S7/9-S26-S36/37/39-S45 |
| 主要危害 | 剧毒、腐蚀性 |
| NFPA 704 | |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
氢氟酸是氟化氢的水溶液,可以透过皮肤黏膜、呼吸道及肠胃道吸收。若不慎暴露于氢氟酸,应立即用六氟灵(Hexafluorine)冲洗,若现场无六氟灵,则先以大量清水冲洗20至30分钟,然后以葡萄糖酸钙软膏或药水涂抹,并紧急送医处理[2];若不小心误饮,则要立即喝下大量的高钙牛奶,并需紧急送医处理。
异常特性
编辑氟化氢相对于其他卤素氢化物具有一些异常的物理特性和化学特性。
高熔点及沸点
编辑由于氟原子电负性很大,所以会与氢原子形成氢键,所以沸点较氯化氢、溴化氢、碘化氢等为高。
弱酸性
编辑氢氟酸之水溶液是一种弱酸。一方面由于氟原子半径小,电荷密度高,对氢原子的束缚较大,另一方面由于H-F共价键高度极性,故氟化氢具有分子间氢键,使得氟化氢具有高度化学稳定性,离解度非常低。因此,离解生成之水合氢离子浓度较低,使酸度常数Ka较低。由此氟化氢为弱酸。
酸度变化
编辑其他卤化氢于水中浓度增加,酸度会下降。
对于一般氢卤酸,卤化氢浓度上升至某个程度,每单位体积溶液中之含水量急剧下降,令此反应之平衡位置趋向左边,使离解度下降,酸性下降。但在较浓的氟化氢水溶液中,酸度反而会增加。此现象是由于氟离子之一个反应:
对于氢氟酸,若氟化氢浓度增加,以上反应之平衡位置趋向右边,使氟离子浓度上升。
根据勒沙特列原理,此化学平衡之平衡位置趋向右边以倾向增加氟离子之浓度,故此离解度上升,酸性上升。
侵蚀玻璃性
编辑氢氟酸本身对硅酸盐(硅)及二氧化硅有极强的侵蚀能力。 故可腐蚀玻璃(主要成分是二氧化硅及硅酸盐),是可腐蚀玻璃的酸,所以日常贮存要使用塑料瓶或铅制容器。
作为溶剂
编辑氟化氢是强酸性溶剂,在氟化氢中:
与硝酸反应:HNO3+2HF→H2NO3++HF2-
与硫酸反应:H2SO4+3HF→HSO3F+H3O++HF2-
- 高氯酸显两性。
显碱性时:HClO4+2HF⇌H2ClO4++HF2-
显酸性时:HClO4+HF⇌H2F++ClO4-
一价的氟化物均易溶于氟化氢;二价的氟化物 、 、 溶解度稍大, 、 、 溶解度稍小;三价的氟化物 溶解度稍小;其余二至四价金属的氟化物均难溶。
一些低价过渡金属的氟化物可以将溶剂还原,如 和 ,将溶剂还原,放出氢气,自身被氧化为 和 。
在酸性环境下,氢氟酸非常危险,因为氢离子在酸性环境下会腐蚀皮肤,而氟离子则会将体内的钙,镁离子溶出,将严重破坏生理平衡。
参考文献
编辑- ^ pKa's of Inorganic and Oxo-Acids. D. H. Ripin, D. A. Evans. [2020-03-09]
- ^ 六氟靈使用法則. 永百实业股份有限公司. [2019-08-29]. (原始内容存档于2019-08-29).



