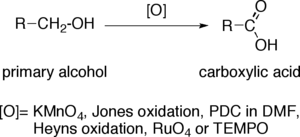
伯醇氧化至羧酸
当伯醇被转化为羧酸,端基碳原子增加了其氧化态至四价。氧化剂可以对于复杂的有机分子进行氧化,而对于具有氧化-敏感官能团的底物则选取氧化剂择需要一定的底物选择性。最常用的氧化剂有:高锰酸钾(KMnO4)、琼斯试剂、PDC的DMF溶液、Heyns氧化试剂、四氧化钌(RuO4)以及TEMPO。
高锰酸钾
编辑高锰酸钾(KMnO4)是一种非常强的氧化剂,可与许多官能团发生反应,如二级醇,1,2-二醇、醛、烯烃、肟、硫化物以及硫醇。在一定的条件下,高锰酸钾能非常高效的将伯醇氧化为羧酸。这个反应最早被Fournier所报道[1][2],他使用了高锰酸钾加入醇的碱性水溶液当中进行反应,得到的反应混合物搅拌至反应完成。由于反应过程很迅速,醇必须要分批的溶解于水溶液当中。该反应还可以使用有机与水的混合溶剂如:二氧六环,吡啶,丙酮或叔丁醇。高锰酸钾在氧化伯醇之前会先与碳碳双键发生反应。
通常,高锰酸钾进行的氧化反应都在强碱性条件下进行,如使用1N NaOH或KOH溶液,因为这会促进氧化的速度以及更好的选择性。对于一些强碱敏感的底物,则反应可在低pH条件下甚至酸性条件下进行,但此法会牺牲反应速率。
高锰酸钾在水中会发生分解,形成二氧化锰(MnO2)和氧气。这种分解反应可被酸、碱或MnO2催化。因此在反应之初很难确定高锰酸钾的实际使用量,而必须在反应过程中逐步增加高锰酸钾的用量直至氧化反应逐步进行完全。
琼斯氧化
编辑所谓的琼斯试剂可通过在硫酸水溶液中溶解三氧化铬(CrO3)制备,性状为红色的含有铬酸(H2CrO4)和其寡聚物的溶液。化学家琼斯最早发现可使用琼斯试剂在丙酮中氧化伯醇至羧酸[4][5]。这种经典的方法是一种“直接加料”的方法,但不可避免的形成相应的副产物酯,具有结构R-CO-O-CH2-R,这种副产物是氧化产生的羧酸和原料醇通过酯化反应产生的。Holland和Gilman[6]证明了这种副反应可通过“反加料”所抑制,操作方法是将伯醇的丙酮溶液缓慢的滴加入琼斯试剂的稀溶液当中。
琼斯试剂与二级醇反应可以氧化至酮化合物[7]。使用琼斯试剂氧化含有一级和二级羟基的醇化合物,可以得到酮酸化合物。
使用琼斯试剂的一大困难是需要操作大量的三氧化铬,这种化合物具有高度毒性且对环境造成污染,因此后来被赵芒柱(Zhao)所改进[8]。该过程使用了高碘酸(H5IO6)作为氧化剂,而CrO3只使用了约1.2 mol%的催化量。Zhao对于琼斯试剂的改进使得这种氧化条件非常适用于大量反应[9]。
PDC的DMF溶液(Corey和Schmidt法)
编辑重铬酸吡啶盐(PDC)是一种亮橙色的固体,具有分子式(C5H5NH)2Cr2O7),常用于氧化伯醇和仲醇分别至醛或酮化合物。另一方面,1979年Corey和Schmidt报道了[11]“饱和”的伯醇与PDC“使用二甲基甲酰胺”(Me2NCHO, DMF)作为溶剂,可氧化伯醇至羧酸而不是醛。有趣的是,当底物为烯丙基或者苄基伯醇时,反应产物则到不了羧酸阶段。Corey和Schmidt的氧化饱和伯醇至羧酸的反应需要在中性条件下进行。
通过分离的醛从醇氧化至羧酸
编辑由于上述的许多氧化伯醇至羧酸的条件大多非常剧烈,对于许多保护基都不适用,因此有机化学家发现可通过两步反应得到氧化的羧酸。伯醇可先氧化至醛阶段,这个方法有许多成熟的方法,如2-碘酰基苯甲酸氧化,戴斯-马丁氧化剂氧化等。醛还可通过Pinnick氧化反应制备,其使用的试剂为亚氯酸钠。[12] 这个方法通常用于天然产物的全合成,Nicolaou等就在平板素的全合成中使用了该方法。[13]
参考文献
编辑- ^ Fournier, H.M. Compt. Rend. Chimie. 1907: 331. 缺少或
|title=为空 (帮助) - ^ Fournier, H.M. Bull. Soc. Chim. Fr. 1909: 920. 缺少或
|title=为空 (帮助) - ^ Ciufolini, M.A.; Swaminathan, S. Synthesis of a model depsipeptide segment of Luzopeptins (BBM 928), potent antitumor and antiretroviral antibiotics. Tetrahedron Lett. 1989, 30 (23): 3027. doi:10.1016/S0040-4039(00)99393-6.
- ^ Heilbron, I.; Jones, E.R.H.; Sondheimer, F. 315. Researches on acetylenic compounds. Part XIV. A study of the reactions of the readily available ethynyl-ethylenic alcohol, pent-2-en-4-yn-1-ol. J. Chem. Soc. 1947: 1586. doi:10.1039/jr9470001586.
- ^ Heilbron, I.; Jones, E.R.H. 129. Researches on acetylenic compounds. Part XV. The oxidation of primary acetylenic carbinols and glycols. J. Chem. Soc. 1949: 604. doi:10.1039/jr9490000604.
- ^ Holland, B.C.; Gilman, N.W. An Improved Procedure for the Oxidation of Alkynols to Alkynoic Acids. Synth. Commun. 1974, 4 (4): 203. doi:10.1080/00397917408062073.
- ^ 参见醇氧化至醛或酮。
- ^ Zhao, M.; Li, J.; Song, Z.; Desmond, R.; Tschaen, D.M.; Grabowski, E.J.J.; Reider, P.J. A novel chromium trioxide catalyzed oxidation of primary alcohols to the carboxylic acids. Tetrahedron Lett. 1998, 39 (30): 5323. doi:10.1016/S0040-4039(98)00987-3.
- ^ Song, Z.J.; Zhao, M.; Desmond, R.; Devine, P.; Tschaen, D.M.; Tillyer, R.; Frey, L.; Heid, R.; Xu, F.; Foster, B.; Li, J.; Reamer, R.; Volante, R.; Grabowski, E.J.J.; Dolling, U.H.; Reider, P.J. Practical Asymmetric Synthesis of an Endothelin Receptor Antagonist. J. Org. Chem. 1999, 64 (26): 9658. doi:10.1021/jo991292t.
- ^ Crimmins, M.T.; and DeBaillie, A.C. Enantioselective Total Synthesis of Bistramide A. J. Am. Chem. Soc. 2006, 128 (15): 4936–7. PMC 2546575 . PMID 16608311. doi:10.1021/ja057686l.
- ^ Corey, E.J.; Schmidt, G. Useful procedures for the oxidation of alcohols involving pyridinium dichromate in approtic media. Tetrahedron Lett. 1979, 20 (52): 399. doi:10.1016/S0040-4039(01)93515-4.
- ^ Bal B.S., Childers, Jr. W.E., Pinnick H.W. Oxidation of α,β-unsaturated aldehydes. Tetrahedron (abstract). 1981, 37 (11): 2091. doi:10.1016/S0040-4020(01)97963-3.
- ^ Nicolaou K.C., Scott Tria G., Edmonds D. J. Total Synthesis of Platencin. Angew. Chem. 2008, 120 (9): 1804. doi:10.1002/ange.200800066.
扩展阅读
编辑- Marcos Fernández; Gabriel Tojo. Oxidation of Primary Alcohols to Carboxylic Acids: A Guide to Current Common Practice (Basic Reactions in Organic Synthesis). Berlin: Springer. 2006. ISBN 0-387-35431-X.