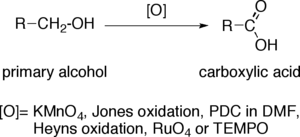
伯醇氧化至羧酸
當伯醇被轉化為羧酸,端基碳原子增加了其氧化態至四價。氧化劑可以對於複雜的有機分子進行氧化,而對於具有氧化-敏感官能團的底物則選取氧化劑擇需要一定的底物選擇性。最常用的氧化劑有:高錳酸鉀(KMnO4)、瓊斯試劑、PDC的DMF溶液、Heyns氧化試劑、四氧化釕(RuO4)以及TEMPO。
高錳酸鉀
編輯高錳酸鉀(KMnO4)是一種非常強的氧化劑,可與許多官能團發生反應,如二級醇,1,2-二醇、醛、烯烴、肟、硫化物以及硫醇。在一定的條件下,高錳酸鉀能非常高效的將伯醇氧化為羧酸。這個反應最早被Fournier所報道[1][2],他使用了高錳酸鉀加入醇的鹼性水溶液當中進行反應,得到的反應混合物攪拌至反應完成。由於反應過程很迅速,醇必須要分批的溶解於水溶液當中。該反應還可以使用有機與水的混合溶劑如:二氧六環,吡啶,丙酮或叔丁醇。高錳酸鉀在氧化伯醇之前會先與碳碳雙鍵發生反應。
通常,高錳酸鉀進行的氧化反應都在強鹼性條件下進行,如使用1N NaOH或KOH溶液,因為這會促進氧化的速度以及更好的選擇性。對於一些強鹼敏感的底物,則反應可在低pH條件下甚至酸性條件下進行,但此法會犧牲反應速率。
高錳酸鉀在水中會發生分解,形成二氧化錳(MnO2)和氧氣。這種分解反應可被酸、鹼或MnO2催化。因此在反應之初很難確定高錳酸鉀的實際使用量,而必須在反應過程中逐步增加高錳酸鉀的用量直至氧化反應逐步進行完全。
瓊斯氧化
編輯所謂的瓊斯試劑可通過在硫酸水溶液中溶解三氧化鉻(CrO3)製備,性狀為紅色的含有鉻酸(H2CrO4)和其寡聚物的溶液。化學家瓊斯最早發現可使用瓊斯試劑在丙酮中氧化伯醇至羧酸[4][5]。這種經典的方法是一種「直接加料」的方法,但不可避免的形成相應的副產物酯,具有結構R-CO-O-CH2-R,這種副產物是氧化產生的羧酸和原料醇通過酯化反應產生的。Holland和Gilman[6]證明了這種副反應可通過「反加料」所抑制,操作方法是將伯醇的丙酮溶液緩慢的滴加入瓊斯試劑的稀溶液當中。
瓊斯試劑與二級醇反應可以氧化至酮化合物[7]。使用瓊斯試劑氧化含有一級和二級羥基的醇化合物,可以得到酮酸化合物。
使用瓊斯試劑的一大困難是需要操作大量的三氧化鉻,這種化合物具有高度毒性且對環境造成污染,因此後來被趙芒柱(Zhao)所改進[8]。該過程使用了高碘酸(H5IO6)作為氧化劑,而CrO3只使用了約1.2 mol%的催化量。Zhao對於瓊斯試劑的改進使得這種氧化條件非常適用於大量反應[9]。
PDC的DMF溶液(Corey和Schmidt法)
編輯重鉻酸吡啶鹽(PDC)是一種亮橙色的固體,具有分子式(C5H5NH)2Cr2O7),常用於氧化伯醇和仲醇分別至醛或酮化合物。另一方面,1979年Corey和Schmidt報道了[11]「飽和」的伯醇與PDC「使用二甲基甲酰胺」(Me2NCHO, DMF)作為溶劑,可氧化伯醇至羧酸而不是醛。有趣的是,當底物為烯丙基或者苄基伯醇時,反應產物則到不了羧酸階段。Corey和Schmidt的氧化飽和伯醇至羧酸的反應需要在中性條件下進行。
通過分離的醛從醇氧化至羧酸
編輯由於上述的許多氧化伯醇至羧酸的條件大多非常劇烈,對於許多保護基都不適用,因此有機化學家發現可通過兩步反應得到氧化的羧酸。伯醇可先氧化至醛階段,這個方法有許多成熟的方法,如2-碘酰基苯甲酸氧化,戴斯-馬丁氧化劑氧化等。醛還可通過Pinnick氧化反應製備,其使用的試劑為亞氯酸鈉。[12] 這個方法通常用於天然產物的全合成,Nicolaou等就在平板素的全合成中使用了該方法。[13]
參考文獻
編輯- ^ Fournier, H.M. Compt. Rend. Chimie. 1907: 331. 缺少或
|title=為空 (幫助) - ^ Fournier, H.M. Bull. Soc. Chim. Fr. 1909: 920. 缺少或
|title=為空 (幫助) - ^ Ciufolini, M.A.; Swaminathan, S. Synthesis of a model depsipeptide segment of Luzopeptins (BBM 928), potent antitumor and antiretroviral antibiotics. Tetrahedron Lett. 1989, 30 (23): 3027. doi:10.1016/S0040-4039(00)99393-6.
- ^ Heilbron, I.; Jones, E.R.H.; Sondheimer, F. 315. Researches on acetylenic compounds. Part XIV. A study of the reactions of the readily available ethynyl-ethylenic alcohol, pent-2-en-4-yn-1-ol. J. Chem. Soc. 1947: 1586. doi:10.1039/jr9470001586.
- ^ Heilbron, I.; Jones, E.R.H. 129. Researches on acetylenic compounds. Part XV. The oxidation of primary acetylenic carbinols and glycols. J. Chem. Soc. 1949: 604. doi:10.1039/jr9490000604.
- ^ Holland, B.C.; Gilman, N.W. An Improved Procedure for the Oxidation of Alkynols to Alkynoic Acids. Synth. Commun. 1974, 4 (4): 203. doi:10.1080/00397917408062073.
- ^ 參見醇氧化至醛或酮。
- ^ Zhao, M.; Li, J.; Song, Z.; Desmond, R.; Tschaen, D.M.; Grabowski, E.J.J.; Reider, P.J. A novel chromium trioxide catalyzed oxidation of primary alcohols to the carboxylic acids. Tetrahedron Lett. 1998, 39 (30): 5323. doi:10.1016/S0040-4039(98)00987-3.
- ^ Song, Z.J.; Zhao, M.; Desmond, R.; Devine, P.; Tschaen, D.M.; Tillyer, R.; Frey, L.; Heid, R.; Xu, F.; Foster, B.; Li, J.; Reamer, R.; Volante, R.; Grabowski, E.J.J.; Dolling, U.H.; Reider, P.J. Practical Asymmetric Synthesis of an Endothelin Receptor Antagonist. J. Org. Chem. 1999, 64 (26): 9658. doi:10.1021/jo991292t.
- ^ Crimmins, M.T.; and DeBaillie, A.C. Enantioselective Total Synthesis of Bistramide A. J. Am. Chem. Soc. 2006, 128 (15): 4936–7. PMC 2546575 . PMID 16608311. doi:10.1021/ja057686l.
- ^ Corey, E.J.; Schmidt, G. Useful procedures for the oxidation of alcohols involving pyridinium dichromate in approtic media. Tetrahedron Lett. 1979, 20 (52): 399. doi:10.1016/S0040-4039(01)93515-4.
- ^ Bal B.S., Childers, Jr. W.E., Pinnick H.W. Oxidation of α,β-unsaturated aldehydes. Tetrahedron (abstract). 1981, 37 (11): 2091. doi:10.1016/S0040-4020(01)97963-3.
- ^ Nicolaou K.C., Scott Tria G., Edmonds D. J. Total Synthesis of Platencin. Angew. Chem. 2008, 120 (9): 1804. doi:10.1002/ange.200800066.
擴展閱讀
編輯- Marcos Fernández; Gabriel Tojo. Oxidation of Primary Alcohols to Carboxylic Acids: A Guide to Current Common Practice (Basic Reactions in Organic Synthesis). Berlin: Springer. 2006. ISBN 0-387-35431-X.