磷酸铁锂
此条目需要补充更多来源。 (2022年11月22日) |
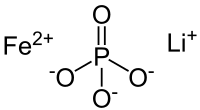
磷酸铁锂(分子式:LiFePO4,英文:Lithium iron phosphate,又称磷酸锂铁、锂铁磷,简称LFP),是一种锂离子电池的正极材料。以其正极材料命名的磷酸铁锂电池也称为铁锂电池,特色是不含钴等贵重元素,原料价格低且磷、铁存在于地球的资源含量丰富,不会有供料问题。其工作电压3.3V、单位重量下电容量大(170mAh/g)、高放电功率、可快速充电且循环寿命长,在高温与高热环境下的稳定性高[1][2]。这个看似不起眼却引发锂电池革命的新材料,为橄榄石结构分类中的一种,矿物学中的学名称为 triphyllite,是从希腊字的 tri- 以及 fylon 两个字根而来,在矿石中的颜色可为灰色、红麻灰色、棕色或黑色,相关的矿物资料可参考:[3]。
| 磷酸铁锂 | |
|---|---|
| |
| IUPAC名 iron(2+) lithium phosphate (1:1:1) | |
| 识别 | |
| CAS号 | 15365-14-7 |
| ChemSpider | 10752170 |
| SMILES |
|
| InChI |
|
| 性质 | |
| 化学式 | LiFePO4 |
| 摩尔质量 | 157.757 g·mol⁻¹ |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
化学式
编辑磷酸铁锂的化学式是LiFePO4,属于磷酸盐锂电池LiMPO4的一种,物理结构则为橄榄石结构,而其中的 M 可以是任何金属,包括 Fe、Co、Mn、Ti 等等,由于最早将 LiMPO4 商业化的公司所制造的材料是 C/LiFePO4,因此大家就这么习惯地把 Lithium iron phosphate 其中的一种材料 LiFePO4 当成是磷酸盐锂电池[1]。从橄榄石结构的化合物而言,可以用在锂离子电池的正极材料并非只有 LiMPO4 一种,据目前所知,与 LiMPO4 相同皆为橄榄石结构的 Lithium iron phosphate 正极材料还有 AyMPO4、Li1-xMFePO4、LiFePO4・MO 等三种与 LiMPO4 不同的橄榄石化合物(均可简称为LFP)。
发现
编辑一般认为美国德州大学的 Arumugam Manthiram 和约翰·B·古迪纳夫(John. B. Goodenough)教授是最初认识到磷酸锂铁可以做为锂离子电池正极材料的研究人员[1]。1996年日本的 NTT 发表 AyMPO4(A为碱金属,M 为 Co Fe 两者之组合:LiFeCoPO4)的橄榄石结构的锂电池正极材料,1997年美国德州大学的约翰·B·古迪纳夫教授等研究团队,也接着报导了 LiFePO4 的可逆性地迁入脱出锂的特性[3],这种新型的橄榄石结构(LiMPO4),使得该材料受到了极大的重视,并引起广泛的研究和迅速的发展。与传统的锂离子电池正极材料,尖晶石结构的 LiMn2O4 和层状结构的 LiCoO2 相比,LiMPO4 的原物料来源更广泛、价格更低廉且无环境污染。
运作原理
编辑LFP 橄榄石结构的锂电池正极材料,已经有多家上游专业材料厂展开量产,预料将彻底大幅扩张锂电池的应用领域,将锂电池带到扩展至电动自行车、油电混合车与电动车的新境界;日本东京工业大学由山田淳夫教授所领导的一个研究小组,在2008年8月11日出版的《自然·材料》报告说,磷酸锂铁离子电池将会被用作清洁环保的电动汽车的动力装置,其前景被普遍看好。由山田淳夫教授所领导的东京工业大学与东北大学的联合研究人员,使用中子射线照射磷酸铁,然后分析中子和物质之间的相互作用来研究锂离子在磷酸铁中的运动状态。研究人员的结论是,在磷酸锂铁中,锂离子按照一定方向笔直地扩散开去,这与锂离子在现有的钴等电极材料中的运动方式不同。这样的结论与原先推估的理论完全一致,使用中子衍射分析的结果,更加证实了磷酸锂铁(LFP)可以确保锂电池的大电流输出输入的安全性。
物理化学性质
编辑磷酸锂铁化学分子式的表示法为:LiMPO4,其中锂为正一价;中心金属铁为正二价;磷酸根为负三价,中心金属铁与周围的六个氧形成以铁为中心共角的八面体 FeO6,而磷酸根中的磷与四个氧原子形成以磷为中心共边的四面体 PO4,借由铁的 FeO6 八面体和磷的 PO4 四面体所构成的空间骨架,共同交替形成 Z 字型的链状结构,而锂离子则占据共边的空间骨架中所构成的八面体位置,晶格中 FeO6 通过 bc 面的共用角连结起来,LiO6 则形成沿着 b 轴方向的共边长链,一个 FeO6 八面体与两个 LiO6 八面体和一个 PO4 四面体共边,而 PO4 四面体则与一个 FeO6 八面体和两个 LiO6 八面体共边。在结晶学的对称分类上属于斜方晶系中的 Pmnb 空间群,单位晶格常数为 a=6.008Å,b=10.334Å,c=4.693Å,单位晶格的体积为 291.4Å3。由于结构中的磷酸基对整个材料的框架具有稳定的作用,使得材料本身具有良好的热稳定性和循环性能。
LiMPO4 中的锂离子不同于传统的正极材料 LiMn2O4 和 LiCoO2,其具有一维方向的可移动性,在充放电过程中可以可逆的脱出和迁入并伴随着中心金属铁的氧化与还原。而 LiMPO4 的理论电容量为 170mAh/g,并且拥有平稳的电压平台 3.45V。其锂离子迁入脱出的反应如下所式:
锂离子脱出后,生成相似结构的 FePO4,但空间群也为 Pmnb,单位晶格常数为 a=5.792Å,b=9.821Å,c=4.788Å,单位晶格的体积为 272.4Å3,锂离子脱出后,晶格的体积减少,这一点与锂的氧化物相似。而 LiMPO4 中的 FeO6 八面体共顶点,因为被 PO43− 四面体的氧原子分隔,无法形成连续的 FeO6 网络结构,从而降低了电子传导性。另一方面,晶体中的氧原子接近于六方最密堆积的方式排列,因此对锂离子仅提供有限的通道,使得室温下锂离子在结构中的迁移速率很小。
在充电的过程中,锂离子和相应的电子由结构中脱出,而在结构中形成新的 FePO4 相,并形成相界面。在放电过程中,锂离子和相应的电子迁入结构中,并在 FePO4 相外面形成新的 LiMPO4 相。因此对于球形的正极材料的颗粒,不论是迁入还是脱出,锂离子都要经历一个由外到内或者是由内到外的结构相的转换程[3][4]。材料在充放电过程中存在一个决定步骤,也就是产生 LixFePO4 / Li1-xFePO4 两相界面。随着锂的不断迁入脱出,界面面积减小,当到达临界表面积后,生成的 FePO4 电子和离子导电率均低,成为两相结构。因此,位于粒子中心的 LiMPO4 得不到充分利用,特别是在大电流的条件下。
若不考虑电子导电性的限制,锂离子在橄榄石结构中的迁移是通过一维通道进行的,并且锂离子的扩散系数高,并且 LiMPO4 经过多次充放电,橄榄石结构依然稳定,铁原子依然处于八面体位置,可以做为循环性能优良的正极材料[5]。在充电过程中,铁原子位于八面体位置,均处于高自旋状态。
LFP的再改良
编辑目前 LFP 材料本身较差的导电性和较低的锂离子扩散系数一直是阻碍其实用化的最主要原因,因而促使各国学者在提高 LiMPO4 的导电能力的方面展开了研究。但由于其极低的电子导电率(10-10~10-9 S/cm)是限制其实际应用的最主要因素。A123 已经能够透过包覆、取代、制备成纳米级材料等改质的方法来克服此一缺点。加入导电物质为了提高脱锂后的 FePO4 的电子导电性,可以在 LiMPO4 粉末间引入分散性能良好的导电剂,例如碳黑或碳[6],可以明显提高粒子间的导电性能,使得 LiMPO4 的利用效率提高,可逆电容量可以达到理论值的95%,即使是在5C的大电流充放电条件下循环性能表现亦十分良好[7][8]。
另外,利用无机氧化物进行表面包覆的方法亦是提高结构稳定性增加材料导电度的手段之一,在传统的 LiCoO2 中包覆后的循环性能有了明显的提高,并且包覆层可以防止钴的溶解,抑制电容量的衰退,同样地,将 LiMPO4 晶粒进行无机物(如 ZnO[9] 或 ZrO2[10])的表面包覆,除了可以改善循环寿命上的表现,亦可增进电容量与大电流放电时的表现。
由于加入导电性碳能够提高 LiMPO4 的利用效率,而像是日本三井造船与 Aleees 则发表加入其他具有导电性能的金属如铜或银的粒子也可以达到同样的效果[11],加入1%重量百分比的金属后,可逆容量可达140mAh/g,而且大电流放电性能都比较理想。
这种电池的低温特性需要改进,在-20度时,容量只有50%,这样一来,很多用了这种电池的产品无法销售到一些冬天比较寒冷之地区,比如中国的北方、北欧、北美等等。
金属位置的取代
编辑为了提高 LiMPO4 的利用效率,也可以进行铁原子位置或锂原子位置的取代,A123 与 VALENCE 曾经发表以镁、钛、锰、锆、锌进行取代;以锌的取代为例,由于锌的离子半径与铁的离子半径相近,因此以锌原子取代之后,LiMPO4 的结晶性有一定程度的提高[12]。而借由循环伏安法的量测可以看出,经由金属原子取代之后的 LiFe1-xMxPO4,锂离子迁入和脱出的可逆性可以得到提升,并且也抑制了二价铁离子在脱出锂后变为三价铁时,晶格体积变小后产生往返路径变化的影响。
LFP制备方式改良与工业化
编辑与锂金属氧化物一样,LiMPO4 可以采用的合成制作方式大约分为以下的方法:
- 固相合成法
- 乳化干燥法
- 溶胶凝胶法
- 溶液共沉法
- 气相沉积法
- 电化学合成法
- 电子束辐照合成法
- 微波法
- 水热法
- 超声波裂解法
- 喷雾裂解法等,
依据工艺的不同可以达到不同的结果,例如,乳化干燥法是先将煤油与乳化剂混合,然后与锂盐、铁盐的水溶液混合,利用该法可以控制碳粒子的大小在纳米范围[13],而采用水热法可以得到晶形良好的 LiMPO4,但是为了加入导电碳,在水溶液中加入聚乙二醇,再借由热处理过程转变为碳[14],而气相沉积法可以用来制备薄膜型态的 LiMPO4[15]。
参考文献
编辑- ^ 1.0 1.1 1.2 Chung, Hsien-Ching; Nguyen, Thi Dieu Hien; Lin, Shih-Yang; Li, Wei-Bang; Tran, Ngoc Thanh Thuy; Thi Han, Nguyen; Liu, Hsin-Yi; Pham, Hai Duong; Lin, Ming-Fa. Chapter 16 - Engineering integrations, potential applications, and outlooks of Li-ion battery industry. First-Principles Calculations for Cathode, Electrolyte and Anode Battery Materials. IOP Publishing. December 2021.
- ^ Chung, Hsien-Ching. Charge and discharge profiles of repurposed LiFePO4 batteries based on the UL 1974 standard. Scientific Data. 2021-07-02, 8 (1): 165. doi:10.1038/s41597-021-00954-3.
- ^ 3.0 3.1 3.2 Padhi, A. K.; Nanjundaswamy, K. S.; Masquelier, C.; Okada, S.; Goodenough, J. B. Effect of Structure on the Fe3 + / Fe2 + Redox Couple in Iron Phosphates. Journal of The Electrochemical Society. 1997-05-01, 144 (5): 1609–1613. doi:10.1149/1.1837649.
- ^ Srinivasan, Venkat; Newman, John. Discharge Model for the Lithium Iron-Phosphate Electrode. Journal of The Electrochemical Society. 2004, 151 (10): A1517. doi:10.1149/1.1785012.
- ^ Zhang, Jieyuan; Dransfield, Tim; Donahue, Neil M. On the Mechanism for Nitrate Formation via the Peroxy Radical + NO Reaction. The Journal of Physical Chemistry A. 2004-10-01, 108 (42): 9082–9095. doi:10.1021/jp048096x.
- ^ Kwon, Sang Jun; Kim, Cheol Woo; Jeong, Woon Tae; Lee, Kyung Sub. Synthesis and electrochemical properties of olivine LiFePO4 as a cathode material prepared by mechanical alloying. Journal of Power Sources. 2004-10, 137 (1): 93–99. doi:10.1016/j.jpowsour.2004.05.048.
- ^ Haas, O.; Deb, A.; Cairns, E. J.; Wokaun, A. Synchrotron X-Ray Absorption Study of LiFePO[sub 4] Electrodes. Journal of The Electrochemical Society. 2005, 152 (1): A191. doi:10.1149/1.1833316.
- ^ Dominko, R.; Bele, M.; Gaberscek, M.; Remskar, M.; Hanzel, D.; Goupil, J.M.; Pejovnik, S.; Jamnik, J. Porous olivine composites synthesized by sol–gel technique. Journal of Power Sources. 2006-02, 153 (2): 274–280. doi:10.1016/j.jpowsour.2005.05.033.
- ^ León, B.; Vicente, C. Pérez; Tirado, J. L.; Biensan, Ph.; Tessier, C. Optimized Chemical Stability and Electrochemical Performance of LiFePO[sub 4] Composite Materials Obtained by ZnO Coating. Journal of The Electrochemical Society. 2008, 155 (3): A211. doi:10.1149/1.2828039.
- ^ Liu, H.; Wang, G.X.; Wexler, D.; Wang, J.Z.; Liu, H.K. Electrochemical performance of LiFePO4 cathode material coated with ZrO2 nanolayer. Electrochemistry Communications. 2008-01, 10 (1): 165–169. doi:10.1016/j.elecom.2007.11.016.
- ^ Croce, F.; D’ Epifanio, A.; Hassoun, J.; Deptula, A.; Olczac, T.; Scrosati, B. A Novel Concept for the Synthesis of an Improved LiFePO[sub 4] Lithium Battery Cathode. Electrochemical and Solid-State Letters. 2002, 5 (3): A47. doi:10.1149/1.1449302.
- ^ Ni, J.F.; Zhou, H.H.; Chen, J.T.; Zhang, X.X. LiFePO4 doped with ions prepared by co-precipitation method. Materials Letters. 2005-08, 59 (18): 2361–2365. doi:10.1016/j.matlet.2005.02.080.
- ^ Cho, Tae-Hyung; Chung, Hoon-Taek. Synthesis of olivine-type LiFePO4 by emulsion-drying method. Journal of Power Sources. 2004-06, 133 (2): 272–276. doi:10.1016/j.jpowsour.2004.02.015.
- ^ Tajimi, S. Enhanced electrochemical performance of LiFePO4 prepared by hydrothermal reaction. Solid State Ionics. 2004-11, 175 (1-4): 287–290. doi:10.1016/j.ssi.2003.12.033.
- ^ Li, Jianling; Suzuki, Tomohiro; Naga, Kazuhisa; Ohzawa, Yoshimi; Nakajima, Tsuyoshi. Electrochemical performance of LiFePO4 modified by pressure-pulsed chemical vapor infiltration in lithium-ion batteries. Materials Science and Engineering: B. 2007-09, 142 (2-3): 86–92. doi:10.1016/j.mseb.2007.07.003.