蛋白质折叠
此条目需要扩充。 (2007年9月26日) |
蛋白质折叠(英语:Protein folding)是蛋白质获得其功能性结构和构象的物理过程。通过这一物理过程,蛋白质从无规则卷曲折叠成特定的功能性三维结构[1]。在从mRNA序列翻译成线性的氨基酸链时,蛋白质都是以去折叠多肽或无规则卷曲的形式存在。
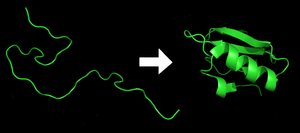

蛋白质的基本单位为氨基酸,而蛋白质的一级结构指的就是其氨基酸序列。蛋白质会由所含氨基酸残基的亲水性、疏水性、带正电、带负电等特性通过残基间的相互作用而折叠成一立体的三级结构。
根据克里斯琴·B·安芬森(1972年的诺贝尔化学奖得主)的研究,蛋白质可由加热或置于某些化学环境而变性,三级结构解体;而当环境回复到原本的状态时,蛋白质可于不到一秒的时间折叠至原先的立体结构,不论试验几次,蛋白质都仅此一种立体结构,于是安芬森提出一个结论:蛋白质分子的一级结构决定其立体结构(安芬森法则)[2]。
安芬森的研究结果非常重要,因为蛋白质的功能取决于其立体结构,而目前根据已知某基因序列可翻译获得对应蛋白质的氨基酸序列,即蛋白质的一级结构;如果从蛋白质的一级结构就能知道立体结构,那么即可直接从基因推测其编码蛋白质所对应的生物学功能。虽然蛋白质可在短时间中从一级结构折叠至立体结构,研究者却无法在短时间中从氨基酸序列计算出蛋白质结构,甚至无法得到准确的三维结构。因此,研究蛋白质折叠的过程,可以说是破译折叠密码的过程。
目前蛋白质的再折叠依然遵从先使用胍或脲变性,然后逐渐降低胍或者脲的浓度,也就是逐渐降低对蛋白质天然“回缩”能力的干扰。使其自然回到天然的最低能量状态。只是这个过程无法很好的控制肽链与肽链之间和肽链内部形成错误折叠的干扰。
折叠与氨基酸序列之间的关系
编辑蛋白质的氨基酸序列决定于氨基酸的特性。蛋白质在生物合成的过程或是生物合成结束后进行折叠。蛋白质折叠受到许多环境因素的影响,例如:溶剂(水、脂类双层),盐的浓度、pH值、温度。可能会出现辅助因子(cofactor)或伴侣因子(chaperon)。
尽量减少疏水性蛋白暴露在水中,对蛋白质折叠来说是一个很好的驱动力,分子内的氢键则可以稳定蛋白质结构。氢键强度与环境有关,因此在自然情况下,被包覆于疏水性核心的氢键和存在于充满水环境下的氢键比起来,对于稳定性的贡献较多。
折叠与翻译是同时进行的(co - translationly),因此蛋白质的C端被核糖体(ribosome)制作出来,N端同时进行折叠的过程。特化的蛋白:伴侣因子可以使蛋白质不与其他蛋白作用(防止非特定区域结合)。最好的例子就是Gro-EL系统,能够阻碍蛋白质非特定区域折叠的球蛋白(globular protein)。在真核生物中,伴侣因子称作热休克蛋白(heat shock protein)。即使球蛋白可以在没有任何辅助的情形下防止蛋白质非特定区域折叠,伴侣因子的作用在细胞内部还是需要的。伴侣因子也可以防止蛋白质在细胞高温或其他环境下产生错误的折叠或聚集。
目前两种蛋白质折叠有两种模型:
- 扩散碰撞模型(diffusion collision model),细胞核形成之时,蛋白质也同时形成二级结构,接着这些二级结构碰撞再一起并紧紧的包住。
- 成核缩合模型(nucleation-condensation model),二级和三级结构同时形成。近期的学说显示出某些蛋白具有以上的折叠现象。
大多数的科学家已能研究出许多相同的蛋白,将其聚合在一起。不论蛋白质是在恶劣的环境或是在天然状态下,氨基酸折叠过程大致上还是一样的,通常会先折叠成一般二级结构(secondary structure)或超二级结构(supersecondary structure),尤其是α-螺旋结构(alpha heliex)和β-折叠结构(beta sheet),之后再形成三级结构,若要形成四级结构则必须要和其他折叠完成的结构进行组装。一般的 α螺旋结构和β折叠结构很快就可以快速折叠因为有分子内的氢键稳定其结构,此现象第一个发现者为莱纳斯·鲍林(Linus Pauling)。蛋白质折叠另外还有共价键结参与──两个半胱氨酸(cysteine)间形成的双硫键 (disulfide bridges)或是金属的聚集(metal clusters)。为了使能量达到稳定分子会形成中间产物:熔球(molten globule)型态。 事实上,每个蛋白质的氨基酸序列都含有在蛋白质在特定状态折叠的讯息,这并不表示的氨基酸折叠方式都是一样的。蛋白质折叠的构型也受到环境的影响,相同的蛋白在不同的环境下也会产生不同的折叠结构。折叠是一个不需消耗能量的自发性过程,折叠主要是由蛋白质的疏水作用主导,形成分子内氢键、凡德瓦力。
自然状态的阻扰
编辑蛋白质在某些情况下会形成有别于一般生物折叠的折叠结构,当环境的温度超出或低于细胞所能承受的温度时,会造成蛋白质的展开(unfold)或是变性,这同时也是蛋白在沸水中变得不透明的原因。高浓度溶液、极端的酸碱值、机械性影响以及其他会使蛋白质变性的溶剂都会造成类似的影响。但是,蛋白质的热平衡常数相当高(即高温才会产生变性的现象)。以超级嗜热菌(hyperthermophilic bacteria)为例,其可在其高温度122℃生存,其体内重要的蛋白质间的组合,在此温度或更高温时仍然能够维持的相当稳定。
一个已完全变性的蛋白质缺乏三级结构与四级结构,形成所谓的随机螺旋(random coil),特定情况下蛋白质可以再次折叠(refold),然而,蛋白质的变性往往是不可逆的。细胞有时候会产生酵素──伴侣因子或热休克蛋白来预防蛋白质在高温中变性,伴侣因子或热休克蛋白可以抵抗蛋白质的不正常折叠与维持、协助正常折叠。有些蛋白质因为彼此间不会有交互作用或其功能为帮助未折叠或折叠错误的蛋白质二度折叠,因此伴侣因子不会阻止此类蛋白质折叠。此现象亦可防止蛋白质沉淀以及防止蛋白质产生不规则形状的结晶。
外在因子对蛋白质折叠的影响
编辑许多外在因子像是温度、电场、磁场、分子的堆积,空间限制对于蛋白质的折叠会有很大的影响。[3] 外在因子若对蛋白质局部极小修饰,亦可引发蛋白质产生不一样的折叠方式。 蛋白质折叠对于蛋白质来说是一个很好的调整过程,不同原子间的氢键所提供的力量是必要的,疏水性蛋白间的疏水性作用包覆住疏水性残基(residue)。
折叠密码
编辑决定蛋白质如何折叠为特定的三级结构的因素称为折叠密码(英语:folding code)。肽链被翻译出来后,多条肽链能自行折叠成蛋白质。但其可能因为环境因素导致折叠错误,需要分子伴侣正确折叠。[4]因此折叠密码并不是决定蛋白质折叠的唯一因素。
蛋白质折叠的预测
编辑折叠密码需根据蛋白质一级结构(下文称“对象”)预测出三级结构来确定[4]。以下为预测的两种方法。
"假设法"
编辑此法在假设折叠后蛋白质的分子构象为热力学最稳定,能量最低状态的基础下,使用分子力学的能量极小化方法,预测对象折叠后的结构。
"规律法"
编辑此法先从已有的蛋白质一级与三维结构之关系找到规律,再用该规律推测出对象折叠后的结构。
蛋白酶解(Proteolysis)
编辑蛋白酶解经常用于探测出在广泛的溶液情况中(有许多影响因子)分离出没有被折叠的蛋白质。快速并行蛋白酶解便是一个很好的例子。
蛋白的不正确折叠与神经退化症
编辑有些不正常的蛋白聚集与许多疾病相关。
朊毒体相关的例如:克雅二氏症(Creutzfeldt-Jakob disease),又称作海绵状脑症(bovine spongiform encephalopathy)。又如牛脑海绵状病变。
淀粉样物质相关的疾病例如:阿兹海默症(Alzheimer's disease)、家族性淀粉样物质心肌病(familial amyloid cardiomyopathy)以及多发性神经病变(polyneuropathy),还有细胞质(包浆)内聚集的疾病,例如:亨丁顿舞蹈症(Huntington's disease)及帕金森氏症(Parkinson's disease)。这些退化性的疾病起因皆与蛋白质的聚集并折叠错误使其不溶于水有关,胞外聚集或包裹在胞内形成 交叉β折叠淀粉样纤维(cross-beta sheet amyloid fibrils)。截至目前并不完全清楚这些不正常的蛋白质聚集现象是造成蛋白质失衡的主因还是只是蛋白质失衡所产生的反应。
参考文献
编辑- ^ Alberts, Bruce; Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, and Peter Walters. The Shape and Structure of Proteins. Molecular Biology of the Cell; Fourth Edition. New York and London: Garland Science. 2002. ISBN 0-8153-3218-1.
- ^ Anfinsen, C. The formation and stabilization of protein structure. Biochem. J. 1972, 128 (4): 737–49. PMC 1173893 . PMID 4565129.
- ^ Rizzuti, B., and Daggett, V. Using simulations to provide the framework for experimental protein folding studies. Arch. Biochem. Biophys. 2013, 531 (1-2): 128–135. PMID 23266569. doi:10.1016/j.abb.2012.12.015.
- ^ 4.0 4.1 蛋白质折叠与“折叠病”和“第二遗传密码”_爱学术. www.ixueshu.com. [2020-07-02]. (原始内容存档于2021-02-10).