乙硼烷
乙硼烷一种是无机化合物,化学式为B2H6,是目前能分离出的最简单的硼烷。乙硼烷在室温下为无色气体,可以与空气形成爆炸性混合物,并且在潮湿空气中自燃。有剧毒。
| 乙硼烷 | |
|---|---|
| |

| |
| IUPAC名 Diborane(6) | |
| 识别 | |
| CAS号 | 19287-45-7 |
| ChemSpider | 17215804 |
| SMILES |
|
| InChI |
|
| InChIKey | KLDBIFITUCWVCC-UHFFFAOYAF |
| EINECS | 242-940-6 |
| ChEBI | 33590 |
| RTECS | HQ9275000 |
| 性质 | |
| 化学式 | B2H6 |
| 摩尔质量 | 27.67 g·mol⁻¹ |
| 外观 | 无色气体 |
| 密度 | 1.18 g/L (15 °C,气态) |
| 熔点 | −165.5 °C [1] (108.15 K) |
| 沸点 | −92.5 °C (180.65 K) |
| 溶解性(水) | 反应 |
| 结构 | |
| 配位几何 | 四面体 (硼) |
| 分子构型 | 见内文 |
| 偶极矩 | 0 D |
| 危险性 | |
| NFPA 704 | |
| 闪点 | 可燃气体 |
| 自燃温度 | 38 °C |
| 相关物质 | |
| 相关硼化合物 | 癸硼烷(14) 三氟化硼 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
乙硼烷具有较高的化学活性,容易与各种无机分子和有机分子起反应。这不仅是因为乙硼烷生成热为正值(即所谓吸热化合物),还由于硼对氟、氧、氮、磷等电负性强的元素有很大的亲合力[2]。
物理性质
编辑乙硼烷为无色气体,其蒸汽压为(3.00×104±133)Pa(-111.6℃),相对密度为0.477(-122℃)及0.577(-183℃)。
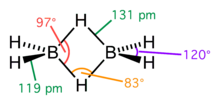
结构
编辑乙硼烷分子具有D2h点群。两个硼原子各用两个 sp2 混成轨域与两个氢原子的 1s 轨道重叠形成 B-H σ键的同时,每个硼原子又用第三个 sp2 混成轨域和余下的一个 p 轨道组合成两个轨道 Φ,分别位于平面上下。两个轨道分别与两个氢原子的 1s 轨道成两个垂直于平面的三中心两电子 BHB 键,正好用上余下的4个价电子[3]。因此乙硼烷分子不能自由旋转。
合成
编辑- MnB + 3H+ → 1/2 B2H6 + Mn3+
- 用单质氢进行氢化:
- BCl3 + 3H2 → 1/2 B2H6 + 3HCl
- R3B + 3H2 → 1/2B2H6 + 3RH
- 6 BF3 + 8 NaH → B2H6 + 6 NaBF4
- 4BCl3 + 3LiAlH4 → 2B2H6 + 3LiAlCl4
- 3LiBH4 + (C2H5)2O.BF3 −(C2H5)2O→ 2B2H6 + 3LiF + (C2H5)2O(纯度90-95%)
- 3NaBH4 + 4BF3 −二甘醚→ 2B2H6 + 3NaBF4
- LiAlH4 + BF3 → B2H6 + LiF + AlF3
- 这个反应在室温即能进行。其机理分为两步,具体如下:
- (1)LiAlH4 + BF3 → LiBH4 + AlF3
- (2)LiBH4 + BF3 → B2H6 + LiF
- 通过质子迁移或电解,从BH4−离子中脱去H−:
- KBH4 + H+ −无水酸→ 1/2 B2H6 + K+ + H2
- LiBH4 −电解→ Li + 1/2 B2H6 + 1/2 H2
- NaBH4 + H2PO3F −真空→ 1/2 B2H6 + NaHPO3F + H2(产率79%)
- KBH4 + H3PO4→ 1/2 B2H6 + H2 + KH2PO4
- 高级硼烷热解:
- 通过配位使高级硼烷降解:
- B4H10 + 2(CH3)2O → (CH3)2O.BH3 + (CH3)2O.B3H7
- (CH3)2O.BH3 → 1/2 B2H6 + (CH3)2O
- 用硼氢化钠还原氯化亚汞:
反应
编辑加合反应
编辑乙硼烷是缺电子化合物,可以与许多配体形成单桥加合物,如C5H5N·B2H6等。这类加合物的通式为:
- L → BH2 … H … BH2
取代反应
编辑乙硼烷分子中的端梢氢原子,可被一些有机基团取代形成各种各样的有机衍生物:
- (6-n) B2H6 + 2n BR3 ⇔ 6 B2H6-nRn (n=1,2,3,4)
形成五、六取代物的同时往往伴随桥键的断裂而发生歧化反应。
卤代乙硼烷(氟除外)可通过B2H6与BX3的平衡反应制取,溴代物也可通过乙硼烷直接溴代获得。 乙硼烷在低温就可以和醇、醚、酮及酯类发生反应[1] :
- B2H6 + 4 CH3OH → 2 HB(OCH3)2 + 4 H2
- B2H6 + 4 CH3COH → 2 HB(OCH2CH3)2
- B2H6 + 4 CH3COCH3 → 2 HB[(OCH2CH3)2]2
- B2H6 + 2 CH3COOC2H5 → 2 HB(OC2H5)2
加成反应
编辑- 3RCH=CH2 + 1/2 B2H6 → (RCH2CH2)3B
- B2H6 + 6 C6H6 → 2 (C6H5)3B + 6 H2
乙硼烷可以和苯在100℃下反应。
- B2H6 + BCl3 ⇔ B2H5Cl
乙硼烷和溴、碘反应分别产生B2H5Br和B2H5I. B2H5Cl极不稳定。 [1]
乙硼烷也可以和一氧化碳反应:
- B2H6 + 2 CO ⇔ 2 BH3CO(羰基甲硼烷)
还原反应
编辑乙硼烷是亲电试剂,并且可将很多官能团还原,如将醛和酮还原为醇,腈还原成胺,肟还原成N-烷基羟胺,施夫碱还原为仲胺等。
乙硼烷极易水解,与水反应生成硼酸和氢:
- B2H6 + 6H2O → 2H3BO3 + 6H2
而相对分子质量较大的戊硼烷和癸硼烷只有加热才能水解。 [1]
- 3 B2H6 + 6 NH3 → 2 B3N3H6 + 12 H2
氧化反应
编辑极纯的硼烷在干燥空气或氧气中并不自燃,但如果有微量杂质存在,就立刻发生自燃现象。[1]
- B2H6 + 3 O2 → B2O3 + 3 H2O
此反应放热很大,故硼烷可在火箭和导弹中用作高能喷射燃料。
二硼烷可以和卤素反应。和氯气的反应很剧烈。[1]
- B2H6 + 6 Cl2 → 2 BCl3 + 6 HCl
用途
编辑储存
编辑参见
编辑参考资料
编辑- ^ 1.0 1.1 1.2 1.3 1.4 1.5 1.6 《硼氢化合物》.郑学家 主编.化学工业出版社. ISBN 978-7-122-11506-5. 第一节 硼烷概述. P5-7.
- ^ 张青莲等。《无机化学丛书》第二卷。北京:科学出版社。
- ^ Laslo P (2000). "A Diborane Story". Angewandte Chemie International Edition 39: 2071-2072. doi:<2071::AID-ANIE2071>3.0.CO;2-C 10.1002/1521-3773(20000616)39:12<2071::AID-ANIE2071>3.0.CO;2-C (页面存档备份,存于互联网档案馆). abstract[永久失效链接]
- ^ 4.0 4.1 N. N. Greenwood, 11. Boron in "Comprehensive Inorganic Chemistry", Vol 1, Eds. J. C. Bailar, H. J. Emeleus, R. Nyholm, A. F. Trotman-Dickeson, Pergamon (1973).
- ^ 5.0 5.1 R. M. Adams, Chapter 7 in "Boron, Metallo-Boron Compounds and Boranes", Interscience (1964).
扩展阅读
编辑- H. C. Brown "Organic Synthesis via Boranes" John Wiley, New York, 1975. ISBN 0-471-11280-1.
