电池
此条目需要补充更多来源。 (2016年11月22日) |
电池(electric battery)全称电池组,是由一个或多个带外部连接的电化学电池(electrochemical cell)组成的电源装置[1],用于为电气设备供电;电池组若由多个电化学电池组成,它们之间可以并联、串联或串并联方式连接。
| 电池 | |
|---|---|
 各种电池和电池组(从左上到右下):两节AA电池,一节D电池,一块手持(业余无线电)电池,两节9伏电池(PP3),两节AAA电池,一节C电池,一块摄像机电池,一块无绳电话电池。 | |
| 类型 | 电源 |
| 工作原理 | 电化学反应, 电动势 |
| 投产年 | 1800s |
| 电路符号 | |
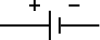 | |

狭义上,电池是将本身储存的化学能转换成电能的装置;广义上,电池是将“预先储存”起来的能量转化为可供外用电能的装置[2]。因此,像太阳能电池,只有转化而无储存功能的装置并不算是电池。其他名称有电瓶、电芯,而中文“池”及“瓶”也有储存作用之意。
英语单一个电池结构叫做“cell”(单电池),内部有多个 cells 并连或串连的结构叫做“battery”(电池组)。虽然在电池发展史上,“battery”一词特指由多个“cells”组成的装置;然而,英语本身的用法也起了演变,“battery”此术语的意涵已演化成涵盖由单一“cell”构成的装置[3]。
电池发展史
编辑电池的历史可以追溯到两千多年前的古伊拉克时代。是在首都巴格达发现的素烧陶壶(巴格达电池)它是一种使用铜和铁的电池。考古者发现的物品被认为是至今发现的最早的电池证据。 而现代真正作为化学能的储藏体,根据人们的需要可控制地放出电能的装置在当时称为Volta Pile(伏打电堆)。第一块真正意义上的现代电池由意大利化学家亚历山德罗·朱塞佩·安东尼奥·阿纳斯塔西奥·伏打发明。
-
目前已知的全球第一个电池
-
车用铅酸电池
-
穿戴式锂电池
电池种类
编辑化学电池
编辑化学电池、电化电池、电化学电池或电化学池是指通过氧化还原反应,把正极、负极活性物质的化学能,转化为电能的一类装置。与普通氧化还原反应不同的是氧化和还原反应是分开进行的,氧化在负极,还原在正极,而电子得失是通过外部线路进行的,所以形成了电流。这是所有电池的本质特点。经过长期的研究、发展,化学电池迎来了品种繁多,应用广泛的局面。大到一座建筑方能容纳得下的巨大装置,小到以毫米计的类型。现代电子技术的发展,对化学电池提出了很高的要求。每一次化学电池技术的突破,都带来了电子设备革命性的发展。世界上很多电化学科学家,把兴趣集中在做为电动汽车动力的化学电池领域。
干电池和液体电池
编辑干电池和液体电池的区分仅限于早期电池发展的那段时期。最早的电池由装满电解液的玻璃容器和两个电极组成。后来推出了以糊状电解液为基础的电池,也称做干电池。
现在仍然有“液体”电池。一般是体积非常庞大的品种。如那些做为不间断电源的大型固定型铅酸蓄电池或与太阳能电池配套使用的铅酸蓄电池。对于移动设备,有些使用的是全密封,免维护的铅酸蓄电池,这类电池已经成功使用了许多年,其中的电解液硫酸是由硅凝胶固定。
一次性电池和可充电电池
编辑- 一次性电池
一次性电池(Primary Battery)俗称“用完即弃”电池及原电池,因为它们的电量耗尽后,无法再充电使用,只能丢弃。常见的一次性电池包括:
- 碳锌电池—电压约1.5V,电池容量较少,能输出的电流也较少,不会如同碱锰电池在长期存放后,漏出有害腐蚀液体,所以仍被使用于低用电量同时需长期使用的装置,例如钟、红外线摇控等。
- 碱锰电池—电压约1.5V,电池容量及输出的电流较锌锰电池高,但不及镍氢电池,长期存放后漏出有害腐蚀液体。
- 锂电池—电压约3V,电池容量及输出的电流极高,可以存放十年仍有相当电力,但价钱较贵。
其他的一次性电池包括有锌电池、锌空电池、锌汞电池、水银电池、氢氧电池和镁锰电池。
- 可充电电池
可充电电池又称二次电池(Secondary Battery)或二级电池、蓄电池。可充电电池按制作材料和工艺上的不同,其优点是在充电后可多次循环使用,它们可全充放电两百多次甚至达40000次,充电电池的输出电流负荷力要比大部分一次性电池高。常见的类型有:
- 铅酸电池—每个Cell的电压约2V,容量低但可输出较大的功率、电池,常使用于汽车中作启动引擎用,或用于不断电系统(UPS)、无线电机、通信机。
- 镍镉电池NiCd—电压约1.2V,有较强烈的记忆效应,而且容量较低,含有毒物质,对环境有害,现已被淘汰。
- 镍氢电池NiMH—电压约1.2V,有极轻微的记忆效应,容量较镍镉电池及碱性电池大,可充放电循环使用数百至二千几次。旧镍氢电池有较大的自放电,新的低自放电镍氢电池自放电低至与碱性电池相约,而且可在低温下使用(-20℃),充电装置、电压与镍镉电池相同,已取代了镍镉电池,同时也可取代绝大部分碱性电池的用途,也有用于混合动力车的。
- 锂离子电池Li-ion—电压约3.6V、3.7V,锂离子电池具有重量轻(容量是同重量的镍氢电池的1.5倍~2倍)、容量大、无记忆效应等优点,具有很低的自放电率,因而即使价格相对较高,仍然得到了普遍应用,包括许多电子产品,而且不含有毒物质,但这类用于消费性电子产品的Li-ion电池在存放一段时期后电量会永久减少。另也有用于纯电动车及混合动力车的Li-ion电池,用于这用途的锂离子电池容量相对略低,但有较大的输出、充电电流,也有的有较长的寿命,但成本较高。
燃料电池
编辑燃料电池是一种将燃料的化学能透过电化学反应直接转化成电能的装置,与一般电化电池不同的是反应物不储存在电池内,只在反应时灌入电池。
燃料电池是利用氢气在阳极进行氧化反应,将氢气氧化成氢离子,而氧气在阴极进行还原反应,与由阳极传来的氢离子结合生成水。氧化还原反应过程中就可以产生电流。
燃料电池的技术包括了出现碱性燃料电池(AFC)、磷酸燃料电池(PAFC)、质子交换膜燃料电池(PEMFC)、熔融碳酸盐燃料电池(MCFC)、固态氧化物燃料电池(SOFC),以及直接甲醇燃料电池(DMFC)等,而其中,利用甲醇氧化反应作为正极反应的燃料电池技术,更是被业界所看好而积极发展。
水启动电池
编辑水启动电池本身不含电解质,出厂时还不会产生电力,须待加入水之后,才让成分间的化学反应得以开始,并产生电力。
核电池
编辑原子能电池(又称核电池,氚电池或放射性同位素发电装置)是指使用放射性同位素衰变时产生之能量来产生电力的装置。这会使人误解成核反应堆,但实际上这种电池不是利用链式反应来产生能量。核电池比起一般电池有很长的寿命且其输出能量远比一般化学电池为高,可惜其制作成本也相对很高,使这种电池多用于一些需长时间运作又难以更换电池的仪器之上。
核电池之技术早在1913年已经被亨利·莫塞莱所发明,使众科学家都期望此技术能够用于太空仪器上。但由于一直无法提高能源效率,这技术到近年纳米技术研发出更有效之半导体后再被关注。此种电池现应用于卫星、宇航工具,也有于地面上使用。第一个离开太阳系的太空探测器航行者一号就是用这类电池作为能源,供应电力给探测器上的仪器。 核电池大致分成两种类,分别是热转换型核电池(例如放射性同位素热电机、斯特林放射性同位素高阶热电机)及非热转换型核电池。
电池容量
编辑电池容量是指电池所能储存的电荷量,电池容量的符号为Q,单位为库伦(C),但日常生活中多以安培小时(Ah)为单位,由于日常生活使用的电池也有容量相对较少,所以也有用毫安培小时(mAh)单位,也即千分之一安培小时,例如手机所使用的电池通常以后者为标记。
决定电池容量的因素有: 电池的种类(也即制造电池的物质):同一体积,不同种类的电池有不同的容量,例如锂电池的容量较很多其他电池为高。 电池的体积:由于物质的化学能的能量密度是固定的,因此体积越大,总藏能量就越多,例如一枚AA电池的容量比AAA电池为大。 电池的温度:一般情况下,温度越低,电池的有效容量会减小,不同种类的电池减小的程度各有不同,所以在寒冷地区使用电池时需要特别留意。 放电速率:放电电流越大,同一电池的有效容量会越小,所以推高耗电的电器时电池的容量会减少,例如一枚能点亮2W灯泡一小时的电池,推动4W灯泡时就不能有半小时,必定比半小时短些,短多少就视乎电池种类、温度…等因素而定。
所以同一枚电池在不同环境下会有不同容量,所以一般电池所标示的容量只可作参考,实际使用仍会因环境及其他工作条件而有所变化。而标示容量一般都以室温情况下作准。
容量、放电电流与C值
编辑要计算一电池在某一放电流下能连续放电多久,方法是将容量除以电流:
当中,t(h)是放电时间(单位是小时)、Q(Ah)是电池容量(单位是安倍小时)、I(A)是电流(安培)。
而放电(或充电)电流也有用C值来表述,1个C的放电电流会刚好在一小时把电池完全放电,也就是1个C的电流是相对电池容量而定。例如一枚600mAh的电池,1个C的电流即是600mA,以这个电流放电会在一小时内用完电量。同样地,对一枚2500mAh的电池,1C就是2500mA。又例如以0.5C对电池放电的话,不管电池容量多小,电池都会在2小时用完(1/0.5=2)。
用C作表述的特点在于在相同电池种类、操作环境下,不同容量的电池在同一C值放电率下,理论上都应该有相约放电时间。所以当要比较不同电池性能时,会选择同一C值的放电或充电速率作比较。电池生产商在电池的规格上也多以C值表述放电电流及充电电流的速率。
电池型号
编辑常见的电池型号或称呼如下:[4]
| 美国型号 | 中国大陆型号 | 台湾型号 | 香港称呼 | 尺寸(高度×直径)mm |
|---|---|---|---|---|
| D | 1号电池 | 1号电池 | 大电 | 59.0*32.3 |
| C | 2号电池 | 2号电池 | 中电 | 49.5*25.3 |
| AA | 5号电池 | 3号电池 | 细电 / 2A电 | 49.0*14.0 |
| AAA | 7号电池 | 4号电池 | 3A电 | 44.0*10.0 |
| AAAA | 9号电池 | 6号电池 | 4A电 | 41.5*8.1 |
| A | 4号电池 | 49.0*16.8 | ||
| SC | 3号电池 | 42.0*22.1 | ||
| N | 8号电池 | 5号电池 | 28.5*11.7 | |
| F | 89.0*32.3 |
寿命
编辑电池寿命(及其同义词电池寿命)对于可充电电池有两个含义,但对于不可充电电池只有一个含义。对于可充电电池,它可以指设备在充满电池电量时运行的时间长度,或是在电池单元失效前可以进行的充放电循环次数。对于不可充电电池,这两种寿命是相等的,因为按定义电池只持续一个循环。(术语“保质期”用于描述电池在制造和使用之间保持性能的时间。)所有电池的可用容量在温度降低时都会下降。与今天大多数电池不同,1812年发明的詹博尼电池堆在不经过翻新或充电的情况下提供了非常长的使用寿命,尽管它仅在纳安(nanoamp)范围内提供电流。自1840年以来,牛津电铃在其原始电池对上几乎持续不断地鸣响,据信这些电池是詹博尼电池堆。
在室温(20–30 °C)下存放时,一次性电池通常每年会失去其原始电荷的8–20%。[5] 这被称为“自放电”速率,是由于即使没有负载,电池单元内部仍然会发生非产生电流的“侧”化学反应。低温下存放的电池的侧反应速率会降低,尽管有些电池可能会受到冷冻的损坏。旧的可充电电池自放电速度比一次性碱性电池快得多,尤其是镍基电池;一个刚刚充满电的镍镉(NiCd)电池在前24小时内会失去10%的电荷,之后以约每月10%的速度放电。然而,较新的低自放电镍金属氢化物(NiMH)电池和现代锂电池设计显示出较低的自放电率(但仍然高于一次性电池)。
电池板上的活性物质在每次充放电循环中都会改变化学组成;由于体积的物理变化,活性物质可能会丢失,从而进一步限制电池的可充电次数。大多数镍基电池在购买时都部分放电,必须在第一次使用之前充电。[6] 较新的NiMH电池在购买时就可以使用,并且一年内只有15%的放电率。[7]
每次充放电循环都会发生一些恶化。降解通常是因为电解质从电极迁移或活性物质从电极分离造成的。低容量的NiMH电池(1,700–2,000 mA·h)可以充电约1,000次,而高容量的NiMH电池(2,500 mA·h以上)大约可以持续500个循环。[8] NiCd电池在其内部电阻永久性地增加到超出可用值之前,往往被评为1,000次循环。快速充电会增加组件变化,缩短电池寿命。[8] 如果充电器不能检测到电池何时充满电,则过充的可能性很大,从而损坏电池。[9]
如果以特定的重复方式使用NiCd电池,可能会出现容量下降的情况,称为“记忆效应”。[10] 这种效应可以通过简单的做法避免。尽管化学性质相似,NiMH电池的记忆效应较少。[11]
汽车的铅酸电池必须承受由振动、冲击和温度范围引起的应力。由于这些应力以及它们的铅板的硫酸盐化,很少有汽车电池在正常使用六年后还能继续使用。[12]汽车起动电池(SLI:起动,照明,点火)电池有许多薄板以最大限度地增加电流。一般来说,板越厚,寿命越长。它们通常只在充电前稍微放电。深循环铅酸电池,如电动高尔夫球车中使用的电池,具有更厚的板以延长寿命。[13][14] 铅酸电池的主要优点是成本低;其主要缺点是在给定容量和电压下,尺寸和重量较大。铅酸电池永远不应放电至其容量的20%以下, 因为内部电阻会在充电时产生热量和损坏。深循环铅酸系统通常使用低电荷警告灯或低电荷断电开关,以防止会缩短电池寿命的损坏类型。[15]
电池寿命可以通过将电池存放在低温环境中来延长,例如冰箱或冰柜,从而减缓侧反应。这种存储可以将碱性电池的寿命延长约5%;可充电电池可以更长时间地保持其电荷,具体取决于类型。[16] 为了达到它们的最大电压,电池必须恢复到室温;在0°C下以250 mAh放电的碱性电池的效率只有在20°C下的一半。[17] 碱性电池制造商,如杜拉克,不建议将电池冷藏。
参见
编辑参考资料
编辑- ^ Crompton, T. R. Battery Reference Book third. Newnes. 2000-03-20: Glossary 3 [2016-03-18]. ISBN 978-0-08-049995-6. (原始内容存档于2021-01-22).
- ^ Feedline:WHAT IS A BATTERY?。. (原始内容存档于2013-04-06).
- ^ Pistoia, Gianfranco. Batteries for Portable Devices. Elsevier. 2005-01-25: 1 [2016-03-18]. ISBN 978-0-08-045556-3. (原始内容存档于2021-01-22).
- ^ 电池型号规格. [2017-09-13]. (原始内容存档于2021-07-28).
- ^ Self discharge of batteries. www.corrosion-doctors.org. [2007-09-09]. (原始内容存档于2007-09-11).
- ^ Energizer Rechargeable Batteries & Battery Chargers. FAQs for Rechargeable Batteries from Energizer.com. web.archive.org. 2009-02-09 [2009-02-03]. 原始内容存档于2009-02-09.
- ^ SANYO eneloop | Ready to use Rechargeable Battery - The only battery you will ever need. web.archive.org. 2010-02-02 [2010-02-03]. (原始内容存档于2010-02-02).
- ^ 8.0 8.1 Rechargeable battery Tips - NIMH Technology Information. web.archive.org. 2007-08-08 [2007-08-012]. (原始内容存档于2007-08-08).
- ^ Battery Myths vs Battery Facts. www.greenbatteries.com. [2007-08-10]. (原始内容存档于2023-05-06).
- ^ Filip M. Gieszczykiewicz. Sci.Electronics FAQ: More Battery Info. www.repairfaq.org. [2018-08-08]. (原始内容存档于2020-10-03).
- ^ RechargheableBatteryInfo.com. What does memory effect mean?. web.archive.org. 2007-07-15 [2007-07-15]. 原始内容存档于2007-07-15.
- ^ Rich, Vincent (1994). The International Lead Trade. Cambridge: Woodhead. 129.
- ^ Deep Cycle Battery FAQ. web.archive.org. 2010-07-22 [2010-08-08]. (原始内容存档于2010-07-22).
- ^ Dire, Daniel J. Tấm pin năng lượng mặt trời 1000w giá bao nhiêu. European Union. 2007-07-26 [2008-08-18]. (原始内容存档于2023-08-07).
- ^ Deep Cycle Batteries: Renewable Energy - Energy Matters. web.archive.org. 2009-02-17 [2009-08-08]. 原始内容存档于2009-02-17.
- ^ Does putting batteries in the freezer make them last longer?. web.archive.org. 2006-04-27 [2006-08-08]. 原始内容存档于2006-04-27.
- ^ Alkaline Manganese Dioxide Handbook and Application Manual (PDF). 2008-08-25 [2023-08-08]. (原始内容存档 (PDF)于2018-10-08).