三氯化铑
三氯化铑(化学式:RhCl3),IUPAC名称氯化铑(III),是最常见和最稳定的铑的氯化物,室温下为暗红色的固体。它是从其他铂系元素中分离铑时的产物。
| 三氯化铑 | |
|---|---|
| |
| IUPAC名 Rhodium(III) chloride | |
| 别名 | 氯化铑 氯化铑(III) |
| 识别 | |
| CAS号 | 10049-07-7 13569-65-8(三水) |
| PubChem | 24872 |
| ChemSpider | 8096382 |
| SMILES |
|
| InChI |
|
| EINECS | 233-165-4 |
| RTECS | VI9290000 |
| 性质 | |
| 化学式 | RhCl3 |
| 摩尔质量 | 209.26 g·mol⁻¹ |
| 外观 | 暗红色固体 |
| 密度 | 5.38 g/cm3(固) |
| 熔点 | 450°C(分解[1]) |
| 溶解性(水) | 可溶 |
| pKa | 溶于水显酸性 |
| 结构 | |
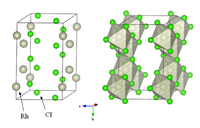
| 晶体结构 | YCl3型结构 |
| 配位几何 | 八面体 |
| 热力学 | |
| ΔfHm⦵298K | -234 kJ/mol |
| 危险性 | |
| 欧盟分类 | 未列明 |
| 闪点 | 不可燃 |
| 相关物质 | |
| 其他阴离子 | 三氟化铑、三溴化铑 三碘化铑 |
| 其他阳离子 | 氯化钴(II)、三氯化铱 |
| 相关化学品 | 三氯化钌、氯化钯 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
无水三氯化铑为聚合分子,与氯化铝类质同晶,在水中的溶解度随制备方法的不同而有差异。三水合三氯化铑(RhCl3·3H2O)是三氯化铑的水合物,也是三氯化铑最常用的形式,可溶于水,通常用于制备其他铑化合物。无水和三水合三氯化铑有很多不同的性质。
性质
编辑RhCl3(H2O)x是暗红色的反磁性晶体,有中等的潮解性,可溶于水得到红色溶液。该水溶液中存在RhCl3(H2O)3、[RhCl2(H2O)4]+和[RhCl(H2O)5]2+等微粒,比例随放置时间长短而有变化。
制备
编辑把摩尔比为1:2的海绵铑和氯化钾一起研细,然后在氯气流中于550°C加热60分钟,用水浸泡红色产物,过滤,滤液中含有K2[Rh(H2O)Cl5],加入足够量的氢氧化钾溶液,沉淀出氢氧化铑(III)(水合三氧化二铑)。洗涤沉淀后,将沉淀溶于尽量少的盐酸中,蒸发溶液近干,就可得到酒红色的RhCl3·3H2O晶体。[2]将该晶体在浓盐酸中重结晶,去除含氮杂质,可以得到较纯净的三氯化铑三水合物。
在200-300°C时,氯气与铑反应,生成红色的RhCl3晶体,该晶体不溶于水。将RhCl3·3H2O在干燥氯化氢气流中加热到180°C,得到能溶于水的RhCl3。在前者反应中,若以熔融的氯化钠作介质,则反应产物为Na3RhCl6。
配合物
编辑三氯化铑三水合物是路易斯酸,可与配体生成种类繁多的配合物。与Rh(I)的平面正方特性不同,Rh(III)的配合物大多为八面体构型,在动力学上比较稳定。
氨配合物
编辑氨与RhCl3·3H2O的乙醇溶液反应生成氯化五氨配离子[RhCl(NH3)5]2+。该离子被锌还原并用硫酸根成盐后,得到无色的氢配合物[RhH(NH3)5]SO4。
硫醚配合物
编辑- RhCl3·3H2O + 3 SR2 → RhCl3(SR2)3 + 3 H2O
反应产物为三氯·三硫醚合铑(III),已经分离出相应的面式(fac-)与经式(mer-)异构体。
叔膦配合物
编辑温和条件下,RhCl3·3H2O与叔膦反应,生成RhCl3(PR3)3类型的配合物。反应若在煮沸乙醇溶液中进行,则铑被还原,生成Rh(I)的配合物,如威尔金森催化剂(Wilkinson's catalyst)—RhCl(PPh3)3。反应中的还原剂为乙醇或三苯基膦,相应氧化产物为乙醛和三苯基氧膦。
- RhCl3·3H2O + 3 PPh3 + CH3CH2OH → RhCl(PPh3)3 + CH3CHO + 2 HCl + 3 H2O
- RhCl3·xH2O + 4 PPh3 → RhCl(PPh3)3 + Ph3P=O + 2 HCl + (x-1) H2O
吡啶配合物
编辑与乙醇和吡啶一起煮沸时,RhCl3·3H2O转化为反式-[RhCl2(py)4)]Cl。若溶剂为水,则得到与硫醚配合物结构类似的面式-RhCl3(py)3。反式-[RhCl2(py)4)]Cl氧化得到蓝色顺磁性的[Cl(py)4Rh-O2Rh(py)4Cl]5+。
烯烃配合物
编辑三氯化铑三水合物也可与烯烃配位,尤其是与降冰片二烯和1,5-环辛二烯一类的二烯烃,生成形式为Rh2Cl2(烯烃)4的配合物。它与1,5-环辛二烯的配合物尤其稳定,甚至在乙醇中与1,3-环辛二烯反应,也会得到1,5-环辛二烯的配合物。双烯配体可由氰离子移除。
羰基配合物
编辑RhCl3·3H2O的甲醇溶液与压强为1bar的一氧化碳反应,生成二氯·二羰基铑(I)酸根阴离子([RhCl2(CO)2]−)。或用RhCl3·3H2O与通入的一氧化碳反应先生成[RhCl(CO)2]2红色固体,然后再将该固体溶于醇并加入氯离子,也可得到[RhCl2(CO)2]−。
Rh(CO)(PR3)类型的化合物(R为有机基团)有很多是氢甲酰化反应的催化剂,其制备与性质也已被广泛研究过。RhCl(PPh3)3与一氧化碳或甲醛反应会生成反式-RhCl(CO)(PPh3)2,与Vaska配合物是同类物质,但不及后者活泼。它会与硼氢化钠和三苯基膦的混合物反应,得到RhH(CO)(PPh3)3。
催化化学
编辑对三水合三氯化铑催化性质的研究大致开始于20世纪60年代。当时发现它对很多涉及一氧化碳、氢气和烯烃的反应都具有催化性能,例如用RhCl3(H2O)3作催化剂,乙烯发生二聚生成顺式和反式2-丁烯的混合物:
- 2 C2H4 → CH3-CH=CH-CH3
然而高级烯烃不能发生该反应。几十年后,人们发现含铑催化的反应在有机溶剂中进行时,有机配体会取代原化合物中的水分子配体,经由(Rh2Cl2(C2H4)4)一类的中间体。该发现推动了均相催化这一领域的发展。这之前大多数金属催化的反应都属于异相催化,反应物与催化剂处于两相,含金属的催化剂为固态,反应底物为液态或气态。
均相催化中,三苯基膦配合物是一类重要的催化剂,显示出较高的催化活性,并且对有机溶剂的溶解性也很好。这类配合物的例子包括RhCl(PPh3)3[3]和RhH(CO)(PPh3)3,可分别催化烯烃的氢化和异构化反应及烯烃的氢甲酰化反应。目前高效的铑催化剂已经在很大程度上替代以前广泛使用且廉价的钴催化剂。
参考资料
编辑- ^ Record of Rhodium(III)-chlorid in the GESTIS Substance Database from the IFA
- ^ Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- ^ Bennet, M. A.; & Longstaff, P. A. (1965). Complexes of Rhodium(I) with Triphenylphosphine. Chem. Ind. (London) 846. Collman, J. P.; Hegedus, L.S.; Norton, J. R.; & Finke, R. G. Principles and Applications of Organotransition Metal Chemistry. Mill Valley (CA):University Science Books. 1987. ISBN 0-935702-51-2.
- Greenwood, N. N.; & Earnshaw, A. Chemistry of the Elements 2nd Ed. Oxford: Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- Canterford, J. H.; & Colton, R. Halides of the Second and Third Row Transition Metals. London: Wiley-Interscience. 1968.
- Cotton, S. A. Chemistry of the Precious Metals. Chapman&Hall. 1997. ISBN 0-7514-0413-6.