氯化铝
氯化铝,或三氯化铝,化学式为,是氯和铝的化合物。氯化铝熔点、沸点都很低,且会升华,为有离子性的共价化合物。熔化的氯化铝不易导电[1],和大多数含卤素离子的盐类(如氯化钠)不同。
| 氯化铝 | |
|---|---|

| |

| |
| IUPAC名 Aluminium(III) chloride | |
| 别名 | 三氯化铝 |
| 识别 | |
| CAS号 | 7446-70-0(无水) 10124-27-3(水合) 7784-13-6(六水合物) |
| PubChem | 24012 |
| ChemSpider | 22445 |
| SMILES |
|
| InChI |
|
| InChIKey | VSCWAEJMTAWNJL-DFZHHIFOAR |
| Gmelin | 1876 |
| ChEBI | 30114 |
| RTECS | BD0530000 |
| 性质 | |
| 化学式 | AlCl3 |
| 摩尔质量 | (无水) 133.34 g·mol−1 (含结晶水) 241.432 g·mol⁻¹ |
| 外观 | 易潮解的黄色或白色固体 |
| 密度 | 2.48 g·cm−3 |
| 熔点 | 190 °C (463 K,2.5 大气压) |
| 沸点 | 183 °C (456 K) 178 °C (451 K)(升华) |
| 溶解性(水) | 43.9 g/100 ml (0°C) 44.9 g/100 ml (10°C) 45.8 g/100 ml (20°C) 46.6 g/100 ml (30°C) 47.3 g/100 ml (40°C) 48.1 g/100 ml (60°C) 48.6 g/100 ml (80°C) 49 g/100 ml (100°C) |
| 结构 | |
| 晶体结构 | 6配位层状晶格 |
| 配位几何 | 八面体(固体), 四面体(液体) |
| 分子构型 | 平面三角形(单分子蒸气) |
| 危险性 | |
| 欧盟危险性符号 | |
| 警示术语 | R:R34 |
| 安全术语 | S:S1/2-S7/8-S28-S45 |
| 相关物质 | |
| 其他阴离子 | 氟化铝,溴化铝,碘化铝 |
| 其他阳离子 | 氯化硼,氯化镓,氯化铟,氯化铊,氯化镁 |
| 相关路易斯酸 | 氯化铁,氟化硼 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
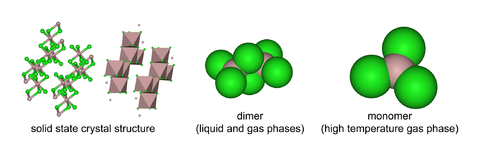
采取结构,为Al3+立方最密堆积层状结构,[2] 而中Al3+却占Br−最密堆积框架的相邻四面体间隙。熔融时生成可挥发的,含有两个三中心四电子氯桥键,更高温度下Al2Cl6二聚体则离解生成平面三角形,与结构类似。
氯化铝是很常用的路易斯酸。在化学工业,它常是傅-克反应的催化剂。它亦用于烃的聚合和异构化反应中。
铝亦可以生成一氯化铝(),但这种化合物很不稳定,只能以气态的形式出现。
工业上,它经铝土矿加工,由铝和氯之间的放热反应所制。
制备
编辑无水氯化铝可由氧化铝和碳的混合物与氯气反应得到:[3]
也可由铝和盐酸的混合物得到:
化学性质
编辑氯化铝是强路易斯酸, 可和路易斯碱作用产生化合物,甚至也可和二苯甲酮和均三甲苯之类的弱路易斯碱作用。[4]若有氯离子存在,氯化铝会生成(四)氯铝酸根离子AlCl4−:
- AlCl3(aq) + Cl−(aq) ⇌ AlCl4−(aq)
在水中,氯化铝会部分水解,形成氯化氢气体或H3O+离子。其水溶液和其他含铝物质的溶液相同,含有水合铝离子,跟适当分量的氢氧化钠反应可生成氢氧化铝沉淀:[5]
- AlCl3(aq) + 3 NaOH(aq) → Al(OH)3(s) + 3NaCl(aq)
- AlCl3(aq) + 3 H2O → AlO2-+ 3HCl + H3O+[来源请求]
用途
编辑氯化铝主要用在傅-克反应[4] 中,例如以苯和光气为原料制备蒽醌,应用于染整工业中。[1] 在广义的傅-克反应中,酰氯或卤代烷和芳香族物质的反应式如下:[4]
苯及其衍生物在发生上述反应时,主产物是对位的异构物。相比较下,烷基化反应涉及的问题较多,不如酰基化反应应用广泛。无论是哪种反应,氯化铝和其他原料和仪器都必须是中等干燥的,少量的水有助于反应进行。
由于氯化铝可与反应产物配位,因此应用在傅克反应时,它的用量必须与反应物相同,而非“催化量”。反应后的氯化铝很难回收,会产生大量的腐蚀性废料。为了达到绿色化学的要求,化学家开始使用三氟化钇或三氟化镝来替代氯化铝,减少污染。
氯化铝也常用来将醛基加在苯环上,如加特曼-科赫反应用一氧化碳、氯化氢、氯化铝及氯化亚铜为催化剂[6]
氯化铝在有机化学中有很广泛的应用。[7] 它可以催化Ene反应,比如3-丁烯-2-酮(甲基乙烯基甲酮)与香芹酮加成:[8]
氯化铝也常用在烃类聚合反应和异构化反应中,重要的例子包括[1] 工业上乙苯的生产。乙苯可用于进一步制备苯乙烯、聚苯乙烯以及用作清洁剂的十二烷基苯。
芳烃存在下,氯化铝与铝混合可用于合成二(芳烃)金属配合物。例如,二苯铬就是通过特定金属卤化物经由Fischer-Hafner合成制备的。
低浓度的碱式氯化铝常是防汗药的成分之一,而多汗症患者在使用时浓度会高些(12%或更高)。
氯化铝和氯化钠不同,其化学键的构成大部分是共价键,而离子键的占比极低,因此熔融态的氯化铝不易电离,且电离产生的Cl-会和氯化铝分子结合生成更稳定的四氯合铝酸根离子AlCl4−;并且氯化铝在180 °C(356 °F)以上的温度下会升华成为气体;因此在工业上不会通过电解氯化铝的方式量产金属铝。但是在熔融态的氯化铝添加氯化钠、无水氯化钙和少量的氯化锂,增强氯化铝分子的电离效率,添加氯酸钾阻止氯化铝的升华;用此方法可以电解制备高纯度的金属铝[9][10]。
注意事项
编辑无水氯化铝会和碱剧烈反应,因此需妥善处理。含结晶水的氯化铝较无此问题。
如果吸入无水氯化铝或接触眼睛和皮肤会造成刺激。
参考文献
编辑- ^ 1.0 1.1 1.2 N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, Pergamon Press, Oxford, United Kingdom, 1984.
- ^ A. F. Wells, Structural Inorganic Chemistry, Oxford Press, Oxford, United Kingdom, 1984.
- ^ Stover, Norman M.; Constantinescu, Clinton (1936). THE REACTION ALUMINIUM OXIDE–CARBON–CHLORINE. Canadian Journal of Research, 14b(9), 328–335. doi:10.1139/cjr36b-038
- ^ 4.0 4.1 4.2 G. A. Olah (ed.), Friedel-Crafts and Related Reactions, Vol. 1, Interscience, New York, 1963.
- ^ 氯化铝字典-Guidechem.com. [2011-12-13]. (原始内容存档于2016-03-05).
- ^ L. G. Wade, Organic Chemistry, 5th edition, Prentice Hall, Upper Saddle River, New Jersey, United States, 2003.
- ^ P. Galatsis, in: Handbook of Reagents for Organic Synthesis: Acidic and Basic Reagents, (H. J. Reich, J. H. Rigby, eds.), pp12-15, Wiley, New York, 1999.
- ^ B. B. Snider, Accounts of Chemical Research 13, 426 (1980).
- ^ 一种从氯化铝中提取纯铝的方法. 谷歌学术. 2023-04-09 [2023-04-09]. (原始内容存档于2023-04-14) (中文(中国大陆)).
- ^ 氯化鋁的製造和電解. 国立台湾大学. 2023-04-09 [2023-04-09]. (原始内容存档于2023-04-12) (中文(台湾)).