嗜鉻細胞
嗜鉻細胞(英語:Chromaffin cell或Pheochromocyte),是主要存在於哺乳動物腎上腺髓質中的神經內分泌細胞。這些細胞具有多種功能,例如對壓力做出反應、監測體內二氧化碳和氧氣濃度、維持呼吸和調節血壓。[1]它們與交感神經系統的突觸前交感神經節非常接近,它們與之交流,並且在結構上它們與突觸後交感神經元相似。為了激活嗜鉻細胞,交感神經系統的內臟神經釋放乙酰膽鹼,然後與腎上腺髓質上的煙鹼型乙酰膽鹼受體結合。這會導致兒茶酚胺的釋放。嗜鉻細胞釋放兒茶酚胺:約80%的腎上腺素和約20%的去甲腎上腺素進入全身循環,對多個器官產生全身作用(類似於下丘腦的分泌神經元),還可以發送旁分泌信號。因此它們被稱為神經內分泌細胞。
| 髓質嗜鉻細胞 | |
|---|---|
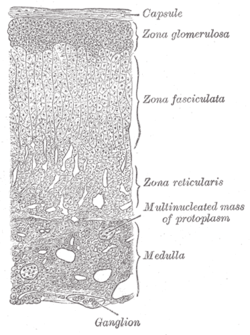 腎上腺 (髓質標記在右下角) | |
| 基本資訊 | |
| 位置 | 髓質腎上腺 |
| 標識字符 | |
| 拉丁文 | endocrinocytus medullaris |
| MeSH | D019439 |
| TH | H3.08.02.6.00015 |
| FMA | FMA:69263 |
| 《顯微解剖學術語》 [在維基數據上編輯] | |
歷史
編輯嗜鉻細胞的英語名中的「chromaffin」來自鉻(chromium)和親和力(affinity)的組合。它們之所以如此命名,是因為它們可以通過用鉻鹽染色來顯現。鉻鹽氧化和聚合兒茶酚胺形成棕色,在分泌去甲腎上腺素的細胞中最為強烈。這個反應被稱作「嗜鉻反應」,也是此細胞中文名的由來。
腸嗜鉻細胞之所以如此命名,是因為它們在組織學上與嗜鉻細胞相似(它們在用鉻鹽處理時也會染成黃色),但它們的功能完全不同,它們不是神經嵴的衍生物。
副神經節是交感神經節附近的嗜鉻細胞或球細胞簇。
結構
編輯有兩種類型的細胞起源於神經嵴並與交感神經系統有關(起源於一種稱為交感神經的細胞):[2]
1)神經母細胞:這些細胞在人類胎兒發育的第4到第5周期間,在脊髓兩側向背主動脈後面的區域遷移,形成兩條交感神經節鏈(交感神經鏈)。從這些神經節中,突觸後的交感神經纖維將出現並向其靶器官延伸。其中一些細胞會遷移到腎上腺髓質,在腎上腺髓質內形成交感神經節細胞(沒有突觸後交感神經纖維)。由這些細胞產生的腫瘤稱為神經母細胞瘤。[3]
2)嗜鉻細胞:這些細胞將遷移到與交感神經節相鄰的區域(因此稱為副神經節)和腎上腺髓質,在那裡它們將成為最豐富的細胞類型。哺乳動物中最大的腎上腺外嗜鉻細胞簇是祖克坎德爾器官。[4]由這些細胞產生的腫瘤稱為副神經節瘤或嗜鉻細胞瘤。這些術語可以互換使用,但通常副神經節瘤是指起源於腎上腺外嗜鉻細胞的腫瘤,也可以稱為腎上腺外嗜鉻細胞瘤,而嗜鉻細胞瘤通常是指起源於腎上腺內嗜鉻細胞的腫瘤。[2]
嗜鉻細胞也在迷走神經和頸動脈附近沉澱。在較低濃度下,腎上腺外嗜鉻細胞也存在於膀胱壁、前列腺和肝臟後面。
在非哺乳動物中,嗜鉻細胞分布在多個地方,一般不作為一個單獨的器官組織,可能沒有神經支配,僅依靠內分泌或旁分泌信號進行分泌。[5][6]
功能
編輯腎上腺髓質的嗜鉻細胞受內臟神經支配,並分泌腎上腺素、去甲腎上腺素、一些多巴胺、腦啡肽和含腦啡肽的肽,以及一些其他激素進入血流。分泌的腎上腺素和去甲腎上腺素在交感神經系統反應中發揮重要作用,通常稱為戰鬥或逃跑反應。腦啡肽和含腦啡肽的肽與稱為內啡肽的內源性肽(由垂體分泌)相關,但又有所不同;所有這些肽都與阿片受體結合併產生鎮痛(和其他)反應。激素由嗜鉻顆粒分泌;這就是多巴胺β羥化酶催化多巴胺轉化為去甲腎上腺素的地方。[7]存在不同的N和E細胞形式(在英國命名法中也存在Na和A細胞,去甲腎上腺素和腎上腺素);前者產生去甲腎上腺素,後者通過與糖皮質激素相互作用從N細胞中產生,並將去甲腎上腺素轉化為腎上腺素。[8]
臨床意義
編輯由這些細胞產生的腫瘤是嗜鉻細胞瘤(與球細胞的非嗜鉻細胞瘤或成副交感神經副神經節瘤形成對比)。有時只有腎上腺起源的腫瘤被稱為嗜鉻細胞瘤,而另一些則被稱為腎上腺外副神經節瘤。
心力衰竭
編輯心力衰竭後,身體會增加腎上腺髓質的交感神經活動,作為增加心率和心輸出量的代償機制。這種增加的交感神經活動導致腎上腺嗜鉻細胞中兒茶酚胺的合成和分泌長期增加。這種腎上腺素和去甲腎上腺素分泌的長期增加導致嗜鉻細胞對兒茶酚胺的脫敏,從而導致其細胞膜上α2腎上腺素能受體的產生和存在減少。α2腎上腺素能受體的這種脫敏和下調是由腎上腺G蛋白偶聯受體激酶2(GRK2)的上調引起的,該酶有效地消除了正常的自分泌型負反饋,該負反饋通常會阻止細胞過度產生兒茶酚胺並將其替換為一個正反饋迴路,其中增加的分泌進一步引起更多的分泌。[9]GRK2的這種上調也伴隨着酪氨酸羥化酶的上調和產量增加,後者催化了兒茶酚胺合成的限速步驟。[10]
參考文獻
編輯- ^ Schober, Andreas; Parlato, Rosanna; Huber, Katrin; Kinscherf, Ralf; Hartleben, Björn; Huber, Tobias B; Schütz, Günther; Unsicker, Klaus. Cell Loss and Autophagy in the Extra-Adrenal Chromaffin Organ of Zuckerkandl are Regulated by Glucocorticoid Signalling. Journal of Neuroendocrinology. 2013, 25 (1): 34–47. ISSN 0953-8194. PMC 3564403 . PMID 23078542. doi:10.1111/j.1365-2826.2012.02367.x.
- ^ 2.0 2.1 Chapter 179. The Paraganglionic System: The Paraganglia - Review of Medical Embryology Book - LifeMap Discovery. discovery.lifemapsc.com. [2017-06-03]. (原始內容存檔於2016-12-20).
- ^ Chapter 164. The Autonomic Nervous System: The Sympathetic System - Review of Medical Embryology Book - LifeMap Discovery. discovery.lifemapsc.com. [2017-06-03]. (原始內容存檔於2017-05-05).
- ^ Schober, Andreas; Parlato, Rosanna; Huber, Katrin; Kinscherf, Ralf; Hartleben, Björn; Huber, Tobias B.; Schütz, Günther; Unsicker, Klaus. Cell Loss and Autophagy in the Extra-Adrenal Chromaffin Organ of Zuckerkandl are Regulated by Glucocorticoid Signalling. Journal of Neuroendocrinology. 1 January 2013, 25 (1): 34–47. PMC 3564403 . PMID 23078542. doi:10.1111/j.1365-2826.2012.02367.x.
- ^ Perry, SF; Capaldo, A. The autonomic nervous system and chromaffin tissue: neuroendocrine regulation of catecholamine secretion in non-mammalian vertebrates.. Autonomic Neuroscience: Basic and Clinical. Nov 16, 2011, 165 (1): 54–66. PMID 20547474. S2CID 42402600. doi:10.1016/j.autneu.2010.04.006.
- ^ Pohorecky, LA; Wurtman, RJ. Adrenocortical control of epinephrine synthesis. (PDF). Pharmacological Reviews. Mar 1971, 23 (1): 1–35 [2013-03-01]. PMID 4941407. (原始內容 (PDF)存檔於2016-03-05).
- ^ Szewczyk, A; Lobanov, NA; Kicińska, A; Wójcik, G; Nałecz, MJ. ATP-sensitive K+ transport in adrenal chromaffin granules. (PDF). Acta Neurobiologiae Experimentalis. 2001, 61 (1): 1–12 [2013-02-25]. PMID 11315316. (原始內容 (PDF)存檔於2017-08-09).
- ^ Young; Lowe; Stevens; Heath (編). Wheater's Functional Histology 5th. Edinburgh: Churchill Livingstone. 2006. ISBN 978-0-443-06850-8.
- ^ Jafferjee, Malika; Reyes Valero, Thairy; Marrero, Christine; McCrink, Katie A.; Brill, Ava; Lymperopoulos, Anastasios. GRK2 Up-Regulation Creates a Positive Feedback Loop for Catecholamine Production in Chromaffin Cells. Molecular Endocrinology. 2016-03-01, 30 (3): 372–381. ISSN 0888-8809. PMC 5414648 . PMID 26849467. doi:10.1210/me.2015-1305.
- ^ Lymperopoulos, Anastasios; Rengo, Giuseppe; Gao, Erhe; Ebert, Steven N.; Dorn, Gerald W.; Koch, Walter J. Reduction of Sympathetic Activity via Adrenal-targeted GRK2 Gene Deletion Attenuates Heart Failure Progression and Improves Cardiac Function after Myocardial Infarction. Journal of Biological Chemistry. 2010-05-21, 285 (21): 16378–16386. ISSN 0021-9258. PMC 2871505 . PMID 20351116. doi:10.1074/jbc.M109.077859 (英語).
外部連結
編輯- Histology image: 14507loa – 波士頓大學的組織學學習系統 - "Endocrine System: adrenal gland, reticularis and medulla"
- Secretion Control in Adrenal Chromaffin Cells
- UC-San Diego Chromaffin Cell and Hypertension Research
- A Primer on Chromaffin Cells (頁面存檔備份,存於網際網路檔案館)
- Rat Chromaffin cells primary cultures: Standardization and quality assessment for single-cell assays (a protocol)