皂化反應
此條目缺少或沒有列出參考或來源,或者有未能查證的內容。 (2013年10月22日) |
皂化反應(英語:Saponification)是一種成皂的化學反應。
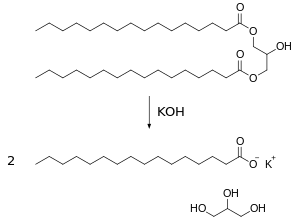
化學反應
編輯皂化反應是較慢的放熱反應,為了加快反應速度,可以在化學反應的過程中:
- 保持系統的較高溫度。(加熱使熟成反應加速)
- 以物理方式不斷攪拌溶液以增加分子碰撞的數量。
- 加入酒精(乙醇),使混合得更充分。(無酒精仍能依靠時間以混合充分)
反應機制
編輯皂化值(皂化價)
編輯習慣上,將1g油脂鹼水解所消耗的氫氧化鉀毫克數定義為皂化值。也可以利用它計算油脂的相對分子質量。
肥皂的製成
編輯
R基可能不同,但生成的R-COONa都可以做肥皂。常見的R-有:
油酸是單不飽和脂肪酸,由油水解得;軟、硬脂酸都是飽和脂肪酸,由脂肪水解得。
如果使用氫氧化鉀水解,得到的肥皂是軟的。
向溶液中加入氯化鈉可以減小脂肪酸鹽的溶解度從而分離出脂肪酸鹽,這一過程叫鹽析。高級脂肪酸鹽是肥皂的主要成分,經填充劑處理可得塊狀肥皂。