組氨酸
組氨酸(英語:Histidine[1], C6H9N3O2)簡寫為His或H,α氨基酸結合咪唑官能團。是存在於蛋白質之中最普遍的20種氨基酸之一。初以為只針對嬰幼兒是必需的,較長期的研究表明,它也是成年人必不可少的必需氨基酸。等電點為7.59,是鹼性氨基酸,生理條件下帶正電荷。他的合成密碼子為 CAU 及 CAC。組氨酸在1896年由德國醫師艾布瑞契·科塞爾(Albrecht Kossel)首次分離出來。
| 組氨酸 | |
|---|---|
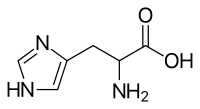
| |

| |
| 縮寫 | His, H |
| 識別 | |
| CAS號 | 71-00-1 |
| PubChem | 773 |
| ChemSpider | 6038 |
| SMILES |
|
| InChI |
|
| InChIKey | HNDVDQJCIGZPNO-YFKPBYRVSA-N |
| ChEBI | 57595 |
| DrugBank | DB00117 |
| KEGG | D00032 |
| IUPHAR配體 | 3310 |
| 性質 | |
| 化學式 | C6H9N3O2 |
| 摩爾質量 | 155.16 g·mol⁻¹ |
| pKa | pKa2 = 6.0 (咪唑環) |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
來源
編輯化學性質
編輯組氨酸的咪唑鏈的pKa大約為6,但總體來看此胺基酸的pKa為7.6。這代表著,於生理上有關的pH值,其相對小的變化會改變平均電荷。在pH小於6時,咪唑鏈會被質子化,有如亨德森-哈塞爾巴爾赫方程所描述的。 當質子化時,咪唑鏈具有兩個NH鍵結並帶正電荷。此正電荷相等地分散於兩個氮原子間,並且形成兩個重要的共振結構。
芳香性
編輯H組氨酸的咪唑鏈在全pH值下為芳香環的形式。 其含有六個pi電子,其中四個電子來自兩個雙鍵,另外兩個來自氮原子的孤對電子。並且可以形成 pi stacking 的交互作用,[2],可是帶正電荷會使此種情形更複雜化[3]。在兩種情形下都不會吸收280nm波長的光譜,可是卻比一些其他的胺基酸於紫外光譜下落在更低的吸收區間。[4][5]
代謝
編輯組氨酸氨裂解酶將組氨酸轉變為氨以及尿刊酸。缺少此酶將導致組氨酸血症這個罕見的代謝疾病。在放線菌門及絲狀真菌中,如粉色麵包黴菌,組氨酸可被轉變成為抗氧化劑麥硫因[6]。
補充
編輯作用
編輯可作為生化試劑和藥劑,還可用於治療心臟病,貧血,風濕性關節炎等的藥物。
補充圖片
編輯-
組氨酸
參考資料
編輯- ^ IUPAC-IUBMB Joint Commission on Biochemical Nomenclature. Nomenclature and Symbolism for Amino Acids and Peptides. Recommendations on Organic & Biochemical Nomenclature, Symbols & Terminology etc. [2007-05-17]. (原始內容存檔於2011-08-21).
- ^ Lijun Wang,, Na Sun,, Simon Terzyan,, Xuejun Zhang, and, David R. Benson. A Histidine/Tryptophan π-Stacking Interaction Stabilizes the Heme-Independent Folding Core of Microsomal Apocytochrome b5 Relative to that of Mitochondrial Apocytochrome b5. Biochemistry 2006 45 (46), 13750-13759
- ^ Robert H. Blessing, Edward L. McGandy. Base stacking and hydrogen bonding in crystals of imidazolium dihydrogen orthophosphate. Journal of the American Chemical Society 1972 94 (11), 4034-4035.
- ^ Katoh R. Absorption Spectra of Imidazolium Ionic Liquids. Chemistry Letters. Vol. 36 (2007) , No. 10 p.1256.
- ^ AR Goldfarb, LJ Saidel, E Mosovich. THE ULTRAVIOLET ABSORPTION SPECTRA OF PROTEINS. Journal of Biological Chemistry, 1951, p.397-404.
- ^ Fahey RC. Novel thiols of prokaryotes. Annu. Rev. Microbiol. 2001, 55: 333–56. PMID 11544359. doi:10.1146/annurev.micro.55.1.333.
- ^ Freeman, Rm; Taylor, Pr. Influence of histidine administration on zinc metabolism in the rat. (Free full text). The American journal of clinical nutrition. Apr 1977, 30 (4): 523–7. ISSN 0002-9165. PMID 851080.
- ^ Wensink, J; Van, Den, Hamer, Cj. Effect of excess dietary histidine on rate of turnover of 65Zn in brain of rat.. Biological trace element research. Jul 1988, 16 (2): 137–50. PMID 2484542. doi:10.1007/BF02797098.