次氯酸鈣
化合物
次氯酸鈣是鈣的次氯酸鹽,化學式為Ca(ClO)2,是漂白粉的主要成分之一,有殺菌性及氧化性。與其性質類似的還有氯氣及次氯酸鈉,但是它們都不如次氯酸鈣的穩定性高。
| 次氯酸鈣 | |
|---|---|
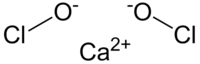
| |
| 英文名 | Calcium hypochlorite |
| 識別 | |
| CAS號 | 7778-54-3 |
| PubChem | 24504 |
| ChemSpider | 22912 |
| SMILES |
|
| InChI |
|
| InChIKey | ZKQDCIXGCQPQNV-UHFFFAOYAV |
| UN編號 | 1748 |
| EINECS | 231-908-7 |
| RTECS | NH3485000 |
| 性質 | |
| 化學式 | Ca(ClO)2 |
| 摩爾質量 | 142.983[1] g·mol⁻¹ |
| 外觀 | 白色微黃固體 有強烈氯氣氣味 |
| 密度 | 2.350 g/cm3[1] |
| 熔點 | 100 °C 分解 |
| 溶解性(水) | 21 g/100 ml (25 °C) |
| 溶解性 | 和酒精反應 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
漂白粉的組分包含次氯酸鈣與氯化鈣、氫氧化鈣和水,真正的分子式可以寫為Ca(ClO)2·CaCl2·Ca(OH)2·2H2O,[2]是一種不易吸水的乾粉。
製備
編輯次氯酸鈣的製備方法有:
- 2 Ca(OH)2 + 2 Cl2 → Ca(ClO)2 + CaCl2 + 2 H2O
- 或氯氣通入氫氧化鈣與氫氧化鈉混合溶液中:
- Ca(OH)2 + 2 Cl2 + 2 NaOH → Ca(ClO)2 + 2 H2O + 2 NaCl
性質
編輯次氯酸鈣在水中的溶解度不大。它的穩定性與含水量成反比,分解反應強烈放熱,產物是氯化鈣及一氧化二氯。次氯酸鈣與二氧化碳反應生成碳酸鈣,放出氯氣:
- 2Ca(ClO)2 + 2CO2 → 2CaCO3 + 2Cl2 + O2
- Ca(ClO)2 + 4 HCl → CaCl2 + 2 H2O + 2 Cl2
次氯酸鈣水解離子方程式:ClO-+H2O→HClO+OH-(可逆)
參考資料
編輯- ^ 1.0 1.1 CRC Handbook of Chemistry and Physics 97th Edition. 2016-06-24: 4–54. ISBN 1-4987-5428-7 (英語).
- ^ 《無機化學叢書》第二卷,鈹、鹼土金屬、硼鋁鎵分族。北京:科學出版社,1984年。