電解
電解(electrolysis)是指將電流通過電解質溶液或熔融態物質,而在陰極和陽極上引起氧化還原反應的過程。電化學電池在接受外加電壓(即充電過程)時,會發生電解過程。
舉例
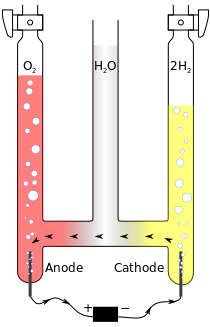
編輯以下為在酸性水溶液中電解水的例子。
- 正極(anode):
- 負極(cathode):
總反應式
在這個反應中,陽極產生放出電子的反應(氧化),陰極產生取得電子的反應(還原)。
歷史
編輯電解的英文electrolysis是由希臘文ἤλεκτρον[ɛ̌ːlektron]「琥珀」和λύσις [lýsis] 「溶解」而來。
應用
編輯電解可用來進行各種電化學的製備和生產,是重要的工業過程。
法拉第定律
編輯電解過程中,在電極發生化學反應而產生的物質的質量與通過電解質的電量成正比。
- 電量=電流×時間(Q=I·t)
法拉第第二電解定律
編輯當相同電量通過不同電解質時,沉積在電極的元素的摩爾數與它的離子所帶的電荷大小成反比。
參見
編輯參考資料
編輯- ^ The Supplement (1803 edition) to Encyclopedia Britannica 3rd edition (1797), volume 1, page 225, "Mister Van Marum, by means of his great electrical machine, decomposed the calces of tin, zinc, and antimony, and resolved them into their respective metals and oxygen" and gives as a reference Journal de Physiques, 1785.
- ^ Sir William Crookes. The Chemical news and journal of industrial science; with which is incorporated the "Chemical gazette.": A journal of practical chemistry in all its applications to pharmacy, arts and manufactures. Chemical news office. 1875: 294– [27 February 2011]. (原始內容存檔於2014-02-10).