貝里斯-希爾曼反應
化学反应
貝里斯-希爾曼反應(Baylis–Hillman reaction),是α,β-不飽和化合物與親電試劑(醛、酮)在合適的催化劑作用下,生成烯烴α-位加成產物的反應。催化劑一般採用DABCO(1,4-二氮雜雙環[2,2,2]辛烷的縮寫形式,俗稱:三亞乙基二胺),生成物為烯丙基醇[1]。這一反應又被稱為森田-貝里斯-希爾曼反應(Morita–Baylis–Hillman reaction),或者簡稱為MBH反應(MBH reaction)[2],這一反應名稱得名自日本化學家森田健一(Ken-ichi Morita)、英國化學家安東尼·貝里斯(Anthony B. Baylis)和德國化學家梅維爾·希爾曼(Melville E. D. Hillman)。
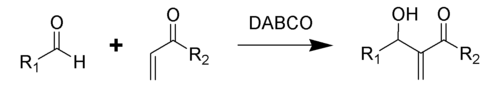
後來,親電試劑擴展到亞胺類sp2型碳的親電試劑,稱為氮雜-貝里斯-希爾曼反應[3]。
反應底物中的親電試劑可以是醛、亞胺、亞胺鹽以及活化的酮。α,β-不飽和化合物(活化烯烴)可以是丙烯酸酯、丙烯醛、乙烯基酮、丙烯腈、α,β-不飽和碸、亞碸、亞胺以及α,β-不飽和環烯酮等缺電子烯烴。
反應機理
編輯貝里斯-希爾曼反應經歷叔胺與活化烯烴的Michael加成反應啟動的加成-消除反應歷程[6]。
反應特點
編輯應用
編輯參見
編輯參考資料
編輯- ^ Baylis, A. B.; Hillman, M. E. D. German Patent. 1972. 缺少或
|title=為空 (幫助) 2,155,113. - ^ Morita, K.; Z. Suzuki, H. Hirose. Bull. Chem. Soc. Jpn. 1968, 41 (2815). 缺少或
|title=為空 (幫助) - ^ Perlmutter, P.; Teo, C. C. Tetrahedron Lett. 1984, 25 (5951). 缺少或
|title=為空 (幫助) - ^ Basavaiah, D.; Rao, P. D.; Hyma, R. S. Tetrahedron. 1996, 52: 8001. 缺少或
|title=為空 (幫助)(綜述) - ^ Ciganek, E. Org. React. 1997, 51 (201). 缺少或
|title=為空 (幫助)(綜述) - ^ Hill, J. S.; Isaacs, N. S. J. Phys. Org. Chem. 1990, 3 (285). 缺少或
|title=為空 (幫助) - ^ Iwabuchi, Y.; Nakatani, M.; Yokoyama, N.; Hatakeyama, S. J. Am. Chem. Soc. 1999, 121 (10219). 缺少或
|title=為空 (幫助) - ^ Iura, Y.; Sugahara, T.; Ogasawara, K. Org. Lett. 2001, 3 (291). 缺少或
|title=為空 (幫助) - ^ Shi, M.; Xu, Y.-M. Angew. Chem. Int. Ed. 2002, 41 (4507). 缺少或
|title=為空 (幫助)