四氯化碲
化合物
四氯化碲是一种无机化合物,化学简式为TeCl4。它具有挥发性,在200 °C(0.1 mm Hg)升华。[1]熔融的TeCl4是离子化合物,可以解离为TeCl3+和Te2Cl102−。[1]
| 四氯化碲 | |
|---|---|
| |
| IUPAC名 Tellurium(IV) chloride Tetratellurium hexadecachloride | |
| 别名 | 氯化碲(IV) |
| 识别 | |
| CAS号 | 10026-07-0 |
| PubChem | 61443 |
| ChemSpider | 55367 |
| SMILES |
|
| InChI |
|
| InChIKey | SWLJJEFSPJCUBD-UHFFFAOYAL |
| 性质 | |
| 化学式 | [TeCl4]4 |
| 摩尔质量 | 1077.64 g/mol g·mol⁻¹ |
| 外观 | 浅黄色吸湿性固体 熔融时为褐红色液体 |
| 密度 | 3.26 g/cm3, solid |
| 熔点 | 224 °C(497 K) |
| 沸点 | 380 °C(653 K) |
| 结构 | |
| 晶体结构 | 单斜晶系,mS80 |
| 空间群 | C12/c1, No. 15 |
| 配位几何 | Distorted octahedral (Te) |
| 分子构型 | Seesaw (gas phase) |
| 偶极矩 | 2.59 D (gas phase) |
| 危险性 | |
| 主要危害 | 有毒、腐蚀性、刺激呼吸道 |
| 相关物质 | |
| 其他阴离子 | 四氟化碲 四溴化碲 四碘化碲 |
| 其他阳离子 | 四氯化硒 四氯化钋 |
| 相关化学品 | 二氯化碲 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
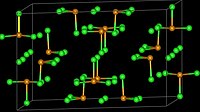
结构
编辑TeCl4在气相为单体,和SF4的结构类似。[2]在固态时的四聚的类立方烷簇合物 Te4Cl16。它有Te4Cl4核,每个Te有三个末端氯化物配体。
制备
编辑TeCl4可以由碲粉和氯气反应得到:
- Te + 2 Cl2 → TeCl4
反应由热引发。产物通过蒸馏分离。[3]
参考文献
编辑- ^ 1.0 1.1 Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- ^ Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred, Advanced Inorganic Chemistry 6th, New York: Wiley-Interscience, 1999, ISBN 0-471-19957-5
- ^ Suttle, J. F.; Smith, C. R. F. Audrieth, Ludwig F. , 编. Tellurium(IV) chloride. Inorganic Syntheses. Inorganic Syntheses. 1950, 3: 140–2. ISBN 978-0-470-13162-6. doi:10.1002/9780470132340.