四氯化碲
化合物
四氯化碲是一種無機化合物,化學簡式為TeCl4。它具有揮發性,在200 °C(0.1 mm Hg)升華。[1]熔融的TeCl4是離子化合物,可以解離為TeCl3+和Te2Cl102−。[1]
| 四氯化碲 | |
|---|---|
| |
| IUPAC名 Tellurium(IV) chloride Tetratellurium hexadecachloride | |
| 別名 | 氯化碲(IV) |
| 識別 | |
| CAS號 | 10026-07-0 |
| PubChem | 61443 |
| ChemSpider | 55367 |
| SMILES |
|
| InChI |
|
| InChIKey | SWLJJEFSPJCUBD-UHFFFAOYAL |
| 性質 | |
| 化學式 | [TeCl4]4 |
| 摩爾質量 | 1077.64 g/mol g·mol⁻¹ |
| 外觀 | 淺黃色吸濕性固體 熔融時為褐紅色液體 |
| 密度 | 3.26 g/cm3, solid |
| 熔點 | 224 °C(497 K) |
| 沸點 | 380 °C(653 K) |
| 結構 | |
| 晶體結構 | 單斜晶系,mS80 |
| 空間群 | C12/c1, No. 15 |
| 配位幾何 | Distorted octahedral (Te) |
| 分子構型 | Seesaw (gas phase) |
| 偶極矩 | 2.59 D (gas phase) |
| 危險性 | |
| 主要危害 | 有毒、腐蝕性、刺激呼吸道 |
| 相關物質 | |
| 其他陰離子 | 四氟化碲 四溴化碲 四碘化碲 |
| 其他陽離子 | 四氯化硒 四氯化釙 |
| 相關化學品 | 二氯化碲 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
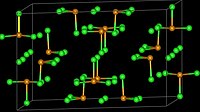
結構
編輯TeCl4在氣相為單體,和SF4的結構類似。[2]在固態時的四聚的類立方烷簇合物 Te4Cl16。它有Te4Cl4核,每個Te有三個末端氯化物配體。
製備
編輯TeCl4可以由碲粉和氯氣反應得到:
- Te + 2 Cl2 → TeCl4
反應由熱引發。產物通過蒸餾分離。[3]
參考文獻
編輯- ^ 1.0 1.1 Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- ^ Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred, Advanced Inorganic Chemistry 6th, New York: Wiley-Interscience, 1999, ISBN 0-471-19957-5
- ^ Suttle, J. F.; Smith, C. R. F. Audrieth, Ludwig F. , 編. Tellurium(IV) chloride. Inorganic Syntheses. Inorganic Syntheses. 1950, 3: 140–2. ISBN 978-0-470-13162-6. doi:10.1002/9780470132340.