巴尔小体
巴尔小体(英语:Barr body),也译作巴氏小体或巴尔氏体,得名自其发现者穆雷·巴尔[1],是哺乳动物(包括人类)在具有多于一个X染色体的细胞中,其中一条去激活的X染色体[2]。X染色体去激活机制由一种名为Xist的长链非编码RNA控制,此RNA介导多种DNA与组蛋白的修饰,抑制基因表达,使其成为异染色质,即巴尔氏体。
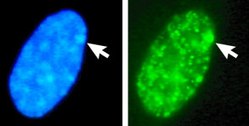
巴尔氏体上除了拟常染色体区的基因仍可表现外,其余片段的基因都受到抑制,这种现象称为基因静默。巴尔氏体产生的目的和避免雌性的X染色体剂量过多有关,造成雌性身体由关闭不同X染色体的两群不同的细胞组成,称为镶嵌体(mosaic),可以产生两种不同的表现型,这也是三色猫有三种毛色的原因。
发现过程
编辑1948年加拿大生物学家穆雷·巴尔和研究生尤尔特·伯特伦研究有关疲劳对大脑的影响,观察猫脑组织,以福尔根试剂将细胞核内的DNA染色。在观察一些母猫神经元时,他意外发现在核膜内缘有一小团染色极深的鼓槌状物质(公猫则没有这样的现象),由于神经元细胞当时不是处在细胞分裂状态,DNA应是散落成染色质,而非结成团状构造。巴尔在观察了其他动物的相关玻片标本后,归纳出一个结论:这些DNA团块是存在雌性哺乳类细胞内的明显差异[3]:179。
次年,巴尔与伯特伦联合出版了一篇论文[4],发表他所发现的奇异现象,当时他将发现的小团鼓槌状物质称为“性染色质”(Sex chromatin),也就是后人所谓的“巴尔氏体”。
1955年,巴尔和解剖学家穆尔(K. L. Moore)观察口腔黏膜发现,女性口腔上皮细胞核膜内缘有同样的小体紧贴在核膜上,而男性却没有[5]。这进一步证明了这个染色较深的小体和性别有关。人们把这个染色较深的小体称为性染色质,又称巴氏小体。
1960年,美国洛杉矶希望之城癌症研究中心的科学家大野干经过彻底研究母鼠的X染色体后宣布,巴尔氏体其实就是X染色体,隔年英国遗传学家玛莉·里昂发表论文,以精简的文字将当时已知的各种现象串连起来,解释巴尔氏体的存在,及它如何以前所未知的方式对哺乳动物造成影响[3]:181。
里昂假说
编辑玛莉·里昂提出,雄鼠和基因型为“XO”的异常雌鼠只有一条X染色体,细胞就能正常运作,因此正常雌鼠也应该只需要一条X染色体就能运作,不用两个激活的X染色体。其次,巴尔氏体在很早期的胚胎阶段就已出现。最后,里昂提出她所观察到小鼠毛色的特殊模式:已知控制毛色的基因位于X染色体,毛色的表现依循伴性遗传,异型合子的雌鼠会出现特有的斑驳毛色,也就是由两种颜色的毛皮组成,随机分布而成斑块状[3]:182。
里昂解释,雌鼠胚胎发育时,细胞会随机关闭一条X染色体,并将其聚缩成巴尔氏体(这条染色体被称为Xi),从此之后,由这些细胞复制、分化来的子细胞,遗传到的两条X染色体中,都有一条是不激活的巴尔氏体,只由另一条正常的X染色体(这条染色体被称为Xa)表现基因,影响细胞运作。结果,雌鼠体内就会含有两大群不同的细胞,用不同条X染色体影响各种性状,因为两个X染色体中哪一个将形成巴尔氏体的选择是随机和独立地发生在胚胎的每一个细胞,包括人在内的雌性哺乳动物其实是两种细胞的镶嵌体(mosaic)[6]。
花猫的毛色
编辑里昂提出,“镶嵌体”的现象不只发生在雌鼠身上,因为雌性独有的斑块毛色现象也出现在其他哺乳动物,里昂以花猫为例,经研究证明她的举例是正确的。
控制猫毛呈橘色或黑色的基因在X染色体上,而控制白色的基因则在常染色体上。正常的“XY”公猫因为只有一个X染色体,只带有黑色或橘色基因,因此外表只可能是全黑或全橘,不会呈现花猫斑块的特征;但拥有“XX”染色体的母猫却可能同时带有黑色和橘色的基因,经过胚胎初期随机的X染色体去激活作用,其毛皮由关闭黑色基因和关闭橘色基因这两群细胞组成,换句话说,每个细胞选择的Xa不同,造成花猫呈现花斑状毛色[3]:183。
结构与机制
编辑巴尔氏体依附在细胞核边缘的核膜内侧,虽然此染色体上的小部分区域能保持着活跃的状态,但大多数的基因都是不会表现的。X染色体去激活发生后,形成巴尔氏体的那条X染色体通常称为Xi,其大部分基因将不会被表现;另一条基因能得到充分表现的X染色体则称为Xa。X染色体失活由一种名为Xist的长链非编码RNA介导,从“X失活中心”(Xic)开始向两侧扩张。
失活过程
编辑失活的X染色体(Xi)由其上的某个点开始往两头产生皱缩,直到染色体的末端,这个开始产生皱缩的点被称为“X失活中心”(英语:X inactivation center, Xic),X失活中心共含有12个基因,其中7个编码蛋白质,另外5个则编码Xist(X-inactive specific transcript,意为失活X染色体特定转录)和Tsix(Xist的反义序列)等长链非编码RNA[8]。Xist是执行X染色体去激活的基因,其转录出的RNA会把Xi包围,介导修饰染色体的酵素与其结合,以进行组蛋白甲基化(例如由多梳家族蛋白(PRC2)造成的H3K27me3[9]、H3K9me3[10])、组蛋白泛素化[11]、CpG位点的DNA甲基化[12]等修饰,达到基因静默的效果,最终使Xi皱缩成巴尔氏体,其上多数基因都无法表达[3]:187[13]。Tsix基因是Xist的反义序列,是Xist的负向调节因子[14],可与Xist结合后,使其被Dicer降解[15]。在X染色体去激活发生之前,两个X染色体均会表达Xist和Tsix,当去激活开始时,Xi将停止表达Tsix,使Xist的表达量增加;Xa则保持Tsix的表达,使Xist的表达量维持在较低水平[16]。另外相较于Xa,Xi染色体中组蛋白乙酰化与组蛋白H3K4me3等促进基因表达的修饰程度均较低[10],且Xi染色体中有一种称为mH2A1的特有组蛋白H2A亚型[17]。
研究人员分析Xist的结构,将其分成数个区域,也已证明了特定区域与计算X染色体数量有关,其中有区域与该选择哪一条X染色体作为Xi有关,有区域与失活的过程有关[3]:188,有一段被称为“A区域”(A region)的片段由两段长长的茎环组成,每段茎环上有四个重复序列,已知与蛋白质的结合有关[18]。另外Xist还有一段序列被称为“C区域”(C region),为与染色体结合的区域[19]。
无论细胞中有几个X染色体(即包括XXY、X0与XX杂合体、XXXY等特殊情况),除了一个X成为Xa之外,其他X染色体上的Xist基因都能正确启动。且Xist不只能作用于X染色体,若将Xist剪接到其他常染色体上,该条染色体也会失去活性[3]:188。而关于生物如何避免让两段X染色体都失活,目前的假说认为常染色体上有某个基因可以制造“阻碍因子”(blocking factor),阻碍因子可与X染色体结合,避免其被去激活,而其他未结合阻碍因子的X染色体则不受保护[20]。
拟常染色体区
编辑在失活的Xi染色体中,仍有少量基因能够表现,即拟常染色体区,其上的基因同时存在于Y染色体,因此这些基因无论在男性或女性体内都表现两倍的剂量,不像X染色体的其他区域基因是单独存在[3]:218。拟常染色体区在人类只占X染色体的一小部分,在老鼠细胞中则占X染色体高达25%,其上只有低量的Xist表现,所以其基因可以得到充分表现。
巴尔氏体中的拟常染色体区基因仍可表现,解释了有多重X染色体(如XXY、XXXY、XXX等)的细胞异常的原因。在高等哺乳类细胞中,除了拟常染色体区之外,还有个别基因可以不同方式调节自己的作用,逃开失活过程[3]:226[21]。
失活的时期
编辑发生X染色体去激活的时间很早,在二细胞至四细胞时期就已发生,其中外细胞团的细胞(extraembryonic tissue,未来将成为胎盘)中的Xi将继续保持失活状态;内细胞团的细胞(inner cell mass,未来将成为胚胎)中的Xi则会复原,之后再失去活性。以老鼠为例,其第一次X染色体去激活受基因印记影响,全部使父系X染色体成为Xi,母系X染色体成为Xa,第二次去激活则是随机选择。这种机制使胎盘的X染色体全为母系,可能可以避免其受母体细胞排斥(但由于控制排斥的基因多不在X染色体上,关闭胎盘的父系X染色体可能无法避免移植排斥,目前这种说法未有定论)[22][3]:193。
演化意义
编辑正常男性只有一条X染色体,女性却有两条,使两者X染色体的剂量不一致,早在1930年代,生物学家就已发现这种染色体含量不均等的问题,并疑惑为何女性不会因为X染色体剂量过多而发生问题[3]:184,里昂的理论则可解释这个问题,为了避免基因过量,女性胚胎会随机让每个细胞的一条X染色体失去活性,变成巴尔氏体,所以女性的每个细胞都只有一个有作用的X染色体,不会产生过量的问题[3]:185。其他动物可能有别的方法避免X染色体剂量不均等,例如线虫不会进行X染色体去激活,而是把雌性两条X染色体的活性都减半[3]:185;果蝇则是雌蝇的两条X染色体都有正常作用,但雄蝇的单一X染色体会发挥两倍的活性[3]:186。
另外,由于不同于常染色体,无论男性或女性都只有一条有用的X染色体,所以X染色体上的基因的活性都需要加倍,以达到正常需求。在演化的过程中,基因有时会移位至别的染色体,但鲜少从常染色体移至X染色体,或从X染色体移至常染色体,因为活性的差异,常染色体的基因若到了X染色体,则其活性只有周围基因的一半;而X染色体的基因若到了常染色体,活性将会是周围基因的两倍,可能是活性导致常染色体和X染色体间产生演化的阻隔,[3]:195。
例外情形
编辑虽然雌性哺乳类身上的细胞几乎都有X染色体去激活的机制,但仍有一些例外情形。
卵子
编辑女性的卵子细胞会将Xist基因关闭,使已经形成的巴尔氏体再次展开,转变回原始的状态。这种机制的目的是母体不能把巴尔氏体传给子代,因为卵子无从得知子代将形成男性或女性,若子代是男性,又遗传到巴尔氏体,就会危及男孩的性命,所以每个女性必须重新启动失活过程。
但由于带有两个功能齐全的X染色体将造成剂量过多的问题,而卵子在形成后将在女性体内存活四十年以上,在这段期间内,卵子如何避免X染色体剂量过多造成的危险情况,目前仍是个谜[3]:190。
有袋类
编辑有研究显示部分有袋类动物(如棕袋鼩)发生X染色体去激活时,不会随机将其中一个染色体失活,而是一律关闭父系的X染色体,故雌性动物除了卵子外都不使用父本基因,因此它们不会形成镶嵌体[3]:191[23]。
再激活
编辑在高等哺乳类细胞中,X染色体去激活的过程更加复杂,除了拟常染色体区之外,还有些个别基因再激活(reactivation)的过程。目前这种机制仍不清楚,但推测可能也与长段非编码RNA的表达有关[21]。有研究发现乳癌患者细胞中的巴尔氏体含量较正常女性低,显示其巴尔氏体可能发生了再激活,还原成正常染色体[24]。
影响
编辑巴尔氏体的产生造成女性成为镶嵌体,对女性的许多疾病和基因表达都有显著的影响。许多费解的现象都能由巴尔氏体获得解释,但部分理论仍不完整,仍需进一步的证据。
同卵双胞胎
编辑同卵双胞胎姊妹间虽然基因大致相同,却可能因为X染色体去激活而产生差异,如果一个女性身上的细胞刚好使用较多的母系X染色体,而她的双胞胎姊妹则偏好使用较多的父系X染色体,则她们的性状(甚至包括罹患遗传疾病与否)都会有所差异。由于女性有约5%的基因存在X染色体上,因此高达5%的基因可能造成同卵双胞胎姊妹的差异(另外无论性别,受精卵分裂成两个个体后,还会发生一些微小变化,亦可造成同卵双胞胎之间的差异)[3]:198。
同卵双胞胎姊妹常偏好使用不同的X染色体,关于此现象的解释有个颇具争议的理论,即女性胚胎细胞在选定失活的X染色体后,会主动将自己分为两大群采用不同Xa的细胞,这两群细胞可能主动排斥而造成胚胎分裂,形成双胞胎。这个理论虽仍有不足之处,例如不能解释同卵双胞胎兄弟的形成,但已经引起相当的讨论[3]:206[25]。
伴性遗传疾病
编辑女性若只有一个带有性联疾病基因的X染色体,并不会发病,因为另一个X染色体上正常的基因可弥补此缺陷。以血友病为例,致病原因是第八凝血因子缺乏,而第八凝血因子是由肝脏制造,控制其生产的基因位在X染色体上,男性因为只有一个X染色体,若基因受损,肝脏即完全无法制造第八因子而致病;而女性若有一个X染色体带有受损基因,则在X染色体去激活的结果下,将有一部分的肝脏细胞有制造第八因子的能力,另一部分则没有,而有制造第八因子能力的那一部分肝脏细胞即足以维持身体的机能,因此有一个X染色体基因受损的女性不会得到血友病[3]:201。
上述是不同细胞可替代彼此功能的例子,但对于无汗症患者而言,该病将导致皮肤缺乏汗腺,因此带有一个缺陷基因的女性将会有一部分皮肤有汗腺,另一部分没有,形成显著的“镶嵌模式”[3]:202。
自体免疫疾病
编辑自体免疫疾病的女性患者多于男性患者,且XXY的男性明显多于正常男性,对此有人主张造成自体免疫的疾病可能和巴尔氏体有关。机制是若胸腺中的细胞在X染色体去激活后偏向使用某一个X染色体,可能导致产生的部分淋巴细胞只认得激活的X染色体和胸腺细胞相同的细胞,而误把失活方向为另一个X染色体的细胞当成外来物质,加以攻击[3]:210[26]。
女性和XXY的男性均有巴尔氏体,而自体免疫疾病的女性患者高达男性的四倍,且XXY的男性比正常男性容易得到自体免疫疾病,以及某些女性的自体免疫疾病呈现镶嵌模式等证据支持这个理论,且已有实验证明两种自体免疫疾病:类风湿性关节炎及桥本氏甲状腺炎的产生均和X染色体去激活有关[27]。但仍有其他理论解释自体免疫疾病的成因,如激素的影响或胎儿细胞的残留[3]:210。
应用
编辑自1968年墨西哥奥运会起,奥运首次开始检测女性运动员的性别,以有巴尔氏体与否作为判断女性的辨识标准,这是区分人类性别的一种简单方式[3]:180。1992年巴塞罗那夏季奥运会之后,国际奥委会改以用聚合酶链锁反应(PCR)的方法检测Y染色体上的SRY基因。1999年后国际奥委会停止进行性别检测,而只对特定有争议的运动员进行个别检测,其中原因包括其衍伸的性别歧视问题(因为只有女性需要做性别检测),以及生物性别不一定等于基因性别等,即应以运动员体内雄性激素表现量来判定他属于男性或女性的体能,而非染色体[28]。2008年的北京奥运,奥运会首次成立“性别鉴定实验中心”,被怀疑性别的女运动员将到此接受筛检,检测项目包括临床、性激素、基因、染色体等[29][30]。
比起刻意隐瞒性别者,比较多的情况是性别处于模糊地带或自己不清楚自己的性别,例如其中有的是睾丸女性化综合征,该疾病会让XY的男性发育成女性的外表[31]。
参考文献
编辑- ^ Barr, M. L.; Bertram, E. G. A Morphological Distinction between Neurones of the Male and Female, and the Behaviour of the Nucleolar Satellite during Accelerated Nucleoprotein Synthesis. Nature. 1949, 163 (4148): 676–7. Bibcode:1949Natur.163..676B. PMID 18120749. S2CID 4093883. doi:10.1038/163676a0.
- ^ Lyon, M. F. The Lyon and the LINE hypothesis. Seminars in Cell & Developmental Biology. 2003, 14 (6): 313–318. PMID 15015738. doi:10.1016/j.semcdb.2003.09.015.
- ^ 3.00 3.01 3.02 3.03 3.04 3.05 3.06 3.07 3.08 3.09 3.10 3.11 3.12 3.13 3.14 3.15 3.16 3.17 3.18 3.19 3.20 3.21 3.22 3.23 班布里基著, 陈雅茜 译. 《X染色體 命運的幕後黑手》. 天下文化出版社. 2004年10月. ISBN 986-417-380-4.
- ^ Murray L. Barr and Ewart G. Bertram. A Morphological Distinction between Neurones of the Male and Female, and the Behaviour of the Nucleolar Satellite during Accelerated Nucleoprotein Synthesis.. Nature. 1949, 163: 676–677. PMID 18120749. doi:10.1038/163676a0.
- ^ W.J. BRADY. Barr, Murray Llewellyn. the canadian encyclopedia.[失效链接]
- ^ Oakes, Elizabeth H. Lyon, Mary Frances. International Encyclopedia of Women Scientists. New York, NY. Facts On File, Inc. 2002. Facts On File, Inc. Science Online.
- ^ Fang R, Moss WN, Rutenberg-Schoenberg M, Simon MD. Probing Xist RNA Structure in Cells Using Targeted Structure-Seq. PLoS Genetics. December 2015, 11 (12): e1005668. PMC 4672913 . PMID 26646615. doi:10.1371/journal.pgen.1005668.
- ^ Rougeulle, Claire; Avner, Philip. Controlling X-inactivation in mammals: what does the centre hold?. Seminars in Cell & Developmental Biology. 2003, 14 (6): 331–340. ISSN 1084-9521. doi:10.1016/j.semcdb.2003.09.014.
- ^ Heard, Edith; Rougeulle, Claire; Arnaud, Danielle; Avner, Philip; Allis, C.David; Spector, David L. Methylation of Histone H3 at Lys-9 Is an Early Mark on the X Chromosome during X Inactivation. Cell. 2001, 107 (6): 727–738. ISSN 0092-8674. doi:10.1016/S0092-8674(01)00598-0.
- ^ 10.0 10.1 Ng, Karen; Pullirsch, Dieter; Leeb, Martin; Wutz, Anton. Xist and the order of silencing. EMBO reports. 2007, 8 (1): 34–39. ISSN 1469-221X. doi:10.1038/sj.embor.7400871.
- ^ de Napoles, Mariana; Mermoud, Jacqueline E.; Wakao, Rika; Tang, Y.Amy; Endoh, Mitusuhiro; Appanah, Ruth; Nesterova, Tatyana B.; Silva, Jose; Otte, Arie P.; Vidal, Miguel; Koseki, Haruhiko; Brockdorff, Neil. Polycomb Group Proteins Ring1A/B Link Ubiquitylation of Histone H2A to Heritable Gene Silencing and X Inactivation. Developmental Cell. 2004, 7 (5): 663–676. ISSN 1534-5807. doi:10.1016/j.devcel.2004.10.005.
- ^ Chadwick, Brian P; Willard, Huntington F. Barring gene expression after XIST: maintaining facultative heterochromatin on the inactive X. Seminars in Cell & Developmental Biology. 2003, 14 (6): 359–367. ISSN 1084-9521. doi:10.1016/j.semcdb.2003.09.016.
- ^ TSIX XIST antisense RNA (non-protein coding) [Homo sapiens]. NCBI. 2010-11-04.
- ^ Mlynarczyk SK, and Panning B. X inactivation: Tsix and Xist as yin and yang. Current Biology. December 2000, 10 (24): R899-903. PMID 11137025 (英语).
- ^ Ogawa, Y.; Sun, B. K.; Lee, J. T. Intersection of the RNA Interference and X-Inactivation Pathways. Science. 2008, 320 (5881): 1336–1341. ISSN 0036-8075. doi:10.1126/science.1157676.
- ^ Lee, Jeannie; Davidow, Lance S; Warshawsky, David. Tsix, a gene antisense to Xist at the X-inactivation centre. Nature Genetics. 1999, 21 (4): 400–404. ISSN 1061-4036. doi:10.1038/7734.
- ^ Costanzi, Carl; Pehrson, John R. Histone macroH2A1 is concentrated in the inactive X chromosome of female mammals. Nature. 1998, 393 (6685): 599–601. ISSN 0028-0836. doi:10.1038/31275.
- ^ Maenner S, Blaud M, Fouillen L; et al. 2-D structure of the A region of Xist RNA and its implication for PRC2 association. PLoS Biol. January 2010, 8 (1): e1000276. PMC 2796953 . PMID 20052282. doi:10.1371/journal.pbio.1000276.
- ^ Beletskii A, Hong YK, Pehrson J, Egholm M, Strauss WM. PNA interference mapping demonstrates functional domains in the noncoding RNA Xist. Proceedings of the National Academy of Sciences of the United States of America. July 2001, 98 (16): 9215–20. PMC 55400 . PMID 11481485. doi:10.1073/pnas.161173098.
- ^ Mlynarczyk, Susanna K; Panning, Barbara. X inactivation: Tsix and Xist as yin and yang. Current Biology. 2000, 10 (24): R899–R903. ISSN 0960-9822. doi:10.1016/S0960-9822(00)00847-2.
- ^ 21.0 21.1 Björn Reinius, Chengxi Shi, Liu Hengshuo, Kuljeet Singh Sandhu, Katarzyna J. Radomska, Glenn D. Rosen, Lu Lu, Klas Kullander, Robert W. Williams and Elena Jazin. Female-biased expression of long non-coding RNAs in domains that escape X-inactivation in mouse. BMC Genomics. November 2010, 11:614 (1): 614 [2011-02-09]. PMID 21047393. doi:10.1186/1471-2164-11-614. (原始内容存档于2010-11-09).
- ^ Cheng, Mimi K.; Disteche, Christine M. Silence of the fathers: Early X inactivation. BioEssays. 2004, 26 (8): 821–824. ISSN 0265-9247. doi:10.1002/bies.20082.
- ^ Johnston PG, Robinson ES. X chromosome inactivation in female embryos of a marsupial mouse (Antechinus stuartii).. School of Biological Sciences, Macquarie University, Sydney, New South Wales, Australia. [2011-02-09]. PMID 2824142. (原始内容存档于2017-11-01).
- ^ Natekar, Prashant E.; DeSouza, Fatima M. Reactivation of inactive X chromosome in buccal smear of carcinoma of breast. Indian Journal of Human Genetics. 2008, 14 (1): 7–8. ISSN 0971-6866. PMC 2840782 . PMID 20300284. doi:10.4103/0971-6866.42320.
- ^ E Watkiss, T Webb, G Rysiecki, N Girdler, E Hewett, and S Bundey. X inactivation patterns in female monozygotic twins and their families. PLoS Biol. (Department of Clinical Genetics, Birmingham Maternity Hospital, Edgbaston, UK). 1994-10 [2011-02-09]. PMID 1050120. (原始内容存档于2021-10-12).
- ^ Knudsen GP. Gender bias in autoimmune diseases: X chromosome inactivation in women with multiple sclerosis.. Department of Adult Mental Health, Division of Mental Health, Norwegian Institute of Public Health, 0403 Oslo, Norway. 2009-05-02 [2011-02-09]. PMID 19411081. (原始内容存档于2016-09-20).
- ^ Chabchoub G, Uz E, Maalej A, Mustafa CA, Rebai A, Mnif M, Bahloul Z, Farid NR, Ozcelik T, Ayadi H. Analysis of skewed X-chromosome inactivation in females with rheumatoid arthritis and autoimmune thyroid diseases.. Laboratoire de Génétique Moléculaire Humaine, Faculté de Médecine de Sfax, Avenue Majida Boulila, Sfax, Tunisia. 2009-05-02 [2011-02-09]. PMID 2745787. (原始内容存档于2020-05-17).
- ^ Olympics Sex Test: Why the Olympic sex test is outmoded, unnecessary and even harmful.. American Medical Association. 1996-07-17 [2011-02-09]. (原始内容存档于2011-01-05) (英语).
- ^ 首設性別鑒定中心‧7天內辨出真女人. 星洲日报. 2008-07-27 [2011-02-09]. (原始内容存档于2009-04-02).
- ^ 李坤. 奥运实验室如何鉴定男女性别. 北京科技报. 2008-08-11 [2019-05-28]. (原始内容存档于2008-08-16).
- ^ Steven M. Carr. Barr Bodies: heterochromatinized X-chromosomes. Memorial University-Department of Biology. 1999 [2011-02-09]. (原始内容存档于2010-06-21).