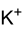甲醇钾
甲醇钾是一种甲醇盐,化学式为CH3OK,可用作强碱和酯交换反应的催化剂,特别是用于生物柴油的生产。
| 甲醇钾 | |||
|---|---|---|---|
| |||
| IUPAC名 Potassium methanolate | |||
| 识别 | |||
| CAS号 | 865-33-8 | ||
| PubChem | 160548 | ||
| ChemSpider | 141079 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | BDAWXSQJJCIFIK-UHFFFAOYAD | ||
| 性质 | |||
| 化学式 | CH3KO | ||
| 摩尔质量 | 70.132 g·mol⁻¹ | ||
| 外观 | 白色粉末 | ||
| 溶解性(水) | 水解 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
制备
编辑在实验室里可用金属钾和甲醇发生(强烈放热)反应来制备甲醇钾,反应会放出等摩尔量的氢。 [1]
钾的氢化物 (氢化钾) 和甲醇反应,也能生成甲醇钾,不过这个反应较少被使用。
氢氧化钾与甲醇的放热反应导致平衡反应生成甲醇钾和水(这反应避免了形成高度易燃的氢气),反应产生的水需要除去,才会让反应向生成甲醇钾的方向持续进行。[2]
由于氢氧化钾的显着吸湿性,其中约含10%的水,因此彻底除去水对于反应转化至关重要。 [3]与氢氧化钠相比,氢氧化钾在甲醇中的明显更高的溶解速率,这对甲醇钾的生成是有利的。
在大规模生产甲醇钾时,人们是通过用甲醇分解钾汞齐来生产甲醇钾的,而钾汞齐是通过汞通过氯化钾的氯碱电解产生的。 人们可以通过超滤的方法消除甲醇中含金属汞的甲醇钾的杂质。 [4] 通过将甲醇蒸馏除去,可得到固体甲醇钾。 由于其简单的生产和用于化学目的更好的处理,优选使用甲醇钾溶液(25%至32%,重量计),其从汞齐中连续取出。
采用具有生态和经济优势的膜工艺代替汞齐工艺来制备大量化学品氢氧化钠和氢氧化钾,这将使这种普通的生产方法在将来无法用于生产碱金属醇盐。 [5]
性质
编辑甲醇钾是一种黄白色,吸水性的无色固体,会与水剧烈反应,形成甲醇和氢氧化钾。 它的水溶液有强碱性,并且有很强的腐蚀性。 这种物质被归类为不可燃物质,不过会在 70 °C 下自燃。[6]
用处
编辑甲醇可以被一氧化碳羰基化,形成甲酸甲酯,该反应需要强碱催化,例如甲醇钾。[7][8]
甲醇钾的主要用途是在生物柴油合成中用作碱酯交换催化剂(以25-32%的甲醇溶液形式)。 植物和动物来源的甘油三酯与甲醇在碱金属甲醇化物的存在下反应,形成相应的脂肪甲酯。 [9][3]
与价格较低的甲醇钠(此处为甘油三酯中的脂肪酸的钾盐)相比,甲醇钾也可促进脂肪皂的形成,而甲醇钾的收率更高。 据报道,由菜籽油生产的生物柴油的最佳条件是甲醇钾的重量为1.59%,反应温度为50℃,甲醇/油比为4.5:1。 生物柴油的产率为95.8%,脂肪酸含量为0.75%。 [10]
论文
编辑- N.Y. Turova; E.P. Turevskaya; V.G. Kessler; M.I. Yanovskaya (编), The Chemistry of Metal Alkoxides, Springer US, 2002, ISBN 978-0-7923-7521-0, doi:10.1007/b113856
参考资料
编辑- ^ A.R. Ronzio (1944). "4-Amino-2,6-dimethylpyrimidine". Org. Synth. 24.
- ^ Chimtek Engineering: Potassium Methylate Production Technology (页面存档备份,存于互联网档案馆), abgerufen am 12. August 2015.
- ^ 3.0 3.1 J. Ruwwe, Metal alkoxides as catalysts for the biodiesel production (PDF), Chim. Oggi Chem. Today 26 (1), 2008, 26 (1): 26–28 [2020-08-14], (原始内容 (PDF)存档于2016-03-04)
- ^ EP 2656905,M. Horn, B. Helpap, M. Thiel, M. Neumann,“Entquickung von Lösungen durch Ultrafiltration”
- ^ ICF International: Study on EU Implementation of the Minamata Convention on Mercury (页面存档备份,存于互联网档案馆), abgerufen am 12. August 2015.
- ^ Evonik Industries, GPS Safety Summary, Potassium Methylate (页面存档备份,存于互联网档案馆), abgerufen am 12. August 2015.
- ^ B.N. Pattanaik, The advances in processes and catalysts for the production of methyl formate by methanol carbonylation – a review, IJCPT 3 (2), 2013, 3 (2): 55–70, ISSN 2277-4807
- ^ US 20140148614,D. Schneider, K.-D. Mohl, M. Schäfer, J. Paschold, J.H. Teles, S. Rittinger,“Process for preparing methyl formate by reaction of methanol with carbon monoxide in the presence of a catalyst system comprising alkali metal formate and alkali metal alkoxide”
- ^ G. Knothe; J. Krahl; J. Van Gerpen (编), The Biodiesel Handbook 2nd, AOCS Press, 2010, ISBN 978-1-893997-62-2
- ^ A. Singh; B. He; J. Thompson; J. Van Gerpen, Process optimization of biodiesel production using alkaline catalysts (PDF), Appl. Eng. Agric. 22 (4), 2006, 22 (4): 597–600 [2017-02-13], (原始内容 (PDF)存档于2015-11-23)