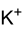甲醇鉀
甲醇鉀是一種甲醇鹽,化學式為CH3OK,可用作強鹼和酯交換反應的催化劑,特別是用於生物柴油的生產。
| 甲醇鉀 | |||
|---|---|---|---|
| |||
| IUPAC名 Potassium methanolate | |||
| 識別 | |||
| CAS號 | 865-33-8 | ||
| PubChem | 160548 | ||
| ChemSpider | 141079 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | BDAWXSQJJCIFIK-UHFFFAOYAD | ||
| 性質 | |||
| 化學式 | CH3KO | ||
| 摩爾質量 | 70.132 g·mol⁻¹ | ||
| 外觀 | 白色粉末 | ||
| 溶解性(水) | 水解 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
製備
編輯在實驗室里可用金屬鉀和甲醇發生(強烈放熱)反應來製備甲醇鉀,反應會放出等摩爾量的氫。 [1]
鉀的氫化物 (氫化鉀) 和甲醇反應,也能生成甲醇鉀,不過這個反應較少被使用。
氫氧化鉀與甲醇的放熱反應導致平衡反應生成甲醇鉀和水(這反應避免了形成高度易燃的氫氣),反應產生的水需要除去,才會讓反應向生成甲醇鉀的方向持續進行。[2]
由於氫氧化鉀的顯着吸濕性,其中約含10%的水,因此徹底除去水對於反應轉化至關重要。 [3]與氫氧化鈉相比,氫氧化鉀在甲醇中的明顯更高的溶解速率,這對甲醇鉀的生成是有利的。
在大規模生產甲醇鉀時,人們是通過用甲醇分解鉀汞齊來生產甲醇鉀的,而鉀汞齊是通過汞通過氯化鉀的氯鹼電解產生的。 人們可以通過超濾的方法消除甲醇中含金屬汞的甲醇鉀的雜質。 [4] 通過將甲醇蒸餾除去,可得到固體甲醇鉀。 由於其簡單的生產和用於化學目的更好的處理,優選使用甲醇鉀溶液(25%至32%,重量計),其從汞齊中連續取出。
採用具有生態和經濟優勢的膜工藝代替汞齊工藝來製備大量化學品氫氧化鈉和氫氧化鉀,這將使這種普通的生產方法在將來無法用於生產鹼金屬醇鹽。 [5]
性質
編輯甲醇鉀是一種黃白色,吸水性的無色固體,會與水劇烈反應,形成甲醇和氫氧化鉀。 它的水溶液有強鹼性,並且有很強的腐蝕性。 這種物質被歸類為不可燃物質,不過會在 70 °C 下自燃。[6]
用處
編輯甲醇可以被一氧化碳羰基化,形成甲酸甲酯,該反應需要強鹼催化,例如甲醇鉀。[7][8]
甲醇鉀的主要用途是在生物柴油合成中用作鹼酯交換催化劑(以25-32%的甲醇溶液形式)。 植物和動物來源的甘油三酯與甲醇在鹼金屬甲醇化物的存在下反應,形成相應的脂肪甲酯。 [9][3]
與價格較低的甲醇鈉(此處為甘油三酯中的脂肪酸的鉀鹽)相比,甲醇鉀也可促進脂肪皂的形成,而甲醇鉀的收率更高。 據報道,由菜籽油生產的生物柴油的最佳條件是甲醇鉀的重量為1.59%,反應溫度為50℃,甲醇/油比為4.5:1。 生物柴油的產率為95.8%,脂肪酸含量為0.75%。 [10]
論文
編輯- N.Y. Turova; E.P. Turevskaya; V.G. Kessler; M.I. Yanovskaya (編), The Chemistry of Metal Alkoxides, Springer US, 2002, ISBN 978-0-7923-7521-0, doi:10.1007/b113856
參考資料
編輯- ^ A.R. Ronzio (1944). "4-Amino-2,6-dimethylpyrimidine". Org. Synth. 24.
- ^ Chimtek Engineering: Potassium Methylate Production Technology (頁面存檔備份,存於網際網路檔案館), abgerufen am 12. August 2015.
- ^ 3.0 3.1 J. Ruwwe, Metal alkoxides as catalysts for the biodiesel production (PDF), Chim. Oggi Chem. Today 26 (1), 2008, 26 (1): 26–28 [2020-08-14], (原始內容 (PDF)存檔於2016-03-04)
- ^ EP 2656905,M. Horn, B. Helpap, M. Thiel, M. Neumann,「Entquickung von Lösungen durch Ultrafiltration」
- ^ ICF International: Study on EU Implementation of the Minamata Convention on Mercury (頁面存檔備份,存於網際網路檔案館), abgerufen am 12. August 2015.
- ^ Evonik Industries, GPS Safety Summary, Potassium Methylate (頁面存檔備份,存於網際網路檔案館), abgerufen am 12. August 2015.
- ^ B.N. Pattanaik, The advances in processes and catalysts for the production of methyl formate by methanol carbonylation – a review, IJCPT 3 (2), 2013, 3 (2): 55–70, ISSN 2277-4807
- ^ US 20140148614,D. Schneider, K.-D. Mohl, M. Schäfer, J. Paschold, J.H. Teles, S. Rittinger,「Process for preparing methyl formate by reaction of methanol with carbon monoxide in the presence of a catalyst system comprising alkali metal formate and alkali metal alkoxide」
- ^ G. Knothe; J. Krahl; J. Van Gerpen (編), The Biodiesel Handbook 2nd, AOCS Press, 2010, ISBN 978-1-893997-62-2
- ^ A. Singh; B. He; J. Thompson; J. Van Gerpen, Process optimization of biodiesel production using alkaline catalysts (PDF), Appl. Eng. Agric. 22 (4), 2006, 22 (4): 597–600 [2017-02-13], (原始內容 (PDF)存檔於2015-11-23)