红腹滨鹬
红腹滨鹬(学名:Calidris canutus)为鹬科滨鹬属的鸟类。是一种中等大小的滨鸟,繁殖于加拿大、欧洲和俄罗斯远北的苔原和北极山脉。它是滨鹬属(Calidris)滨鹬家族中的大型成员,仅次于大滨鹬。[3]目前已确认有六个亚种。该物种的模式产地在瑞典。[2]
| 红腹滨鹬 | |
|---|---|

| |
| 科学分类 | |
| 界: | 动物界 Animalia |
| 门: | 脊索动物门 Chordata |
| 纲: | 鸟纲 Aves |
| 目: | 鸻形目 Charadriiformes |
| 科: | 鹬科 Scolopacidae |
| 属: | 滨鹬属 Calidris |
| 种: | 红腹滨鹬 C. canutus
|
| 二名法 | |
| Calidris canutus | |
| |
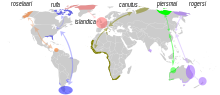
| 六个亚种的分布范围及迁徙路线 | |
| 异名 | |
它们的饮食随着季节变化而有所不同;在繁殖地主要以节肢动物和幼虫为食,而在其他觅食地则以各种硬壳软体动物为主。北美繁殖的红腹滨鹬会迁徙到欧洲和南美洲的沿海地区,而欧亚族群则在非洲、巴布亚新几内亚、澳洲和新西兰过冬。此物种在非繁殖期会形成庞大的群体。
分类、系统学与演化
编辑红腹滨鹬最早由卡尔·林奈在他1758年具有里程碑意义的自然系统第十版中作了物种描述,其拉丁名称为Tringa canutus。[4]有一种说法认为,它的名字和物种名称源自克努特大帝,这个名字指的是滨鹬沿潮线觅食,与克努特与潮水的故事有关。[5]不过,这个辞源学说似乎没有历史依据。[6]另一个说法是,这个名字是拟声词,基于鸟类的低沉叫声。[7]
族群相关性和分歧。多样化事件可能与威斯康星(魏切塞尔)冰期18,000到22,000年前的发生有关;北美洲无冰走廊的开放在12,000到14,000年前;以及7,000到9,000年前的全新世气候最优期。[8] |
红腹滨鹬与大滨鹬最初是唯一被归入属滨鹬属(Calidris)的两个物种,但随后许多其他滨鹬物种也被加入其中。[9]2004年的一项研究发现该属为多系群,且两种滨鹬的最亲近亲属为滨浪鹬(Calidris virgata)。[10]
- C. c. roselaari (Tomkovich, 1990) – (最大)
- C. c. rufa (Wilson, 1813)
- C. c. canutus (Linnaeus, 1758)
- C. c. islandica (Linnaeus, 1767)
- C. c. rogersi (Mathews, 1913)
- C. c. piersmai (Tomkovich, 2001) – (最小)
基于线粒体序列分化和冰川周期期间古气候学模型的研究表明,canutus是最基础的族群,约在20,000年前分离(95%置信区间:60,000至4,000年前),而美国和西伯利亚的繁殖族群约在12,000年前出现两条不同的血统(95%置信区间:45,000至3,500年前)。[8][12]
分布与迁徙
编辑在繁殖季节,红腹滨鹬分布于高北极的环北极地区,然后迁徙至全球从北纬50°到南纬58°的海岸。红腹滨鹬是所有鸟类中迁徙距离最长的物种之一。它每年从北极迁徙超过9,000 mi(14,000 km)到南美洲的最南端,然后再返回北极。[13] 个别亚种的具体迁徙路线和过冬地点仍然不完全确定。指名亚种C. c. canutus繁殖于泰梅尔半岛,可能还包括雅库特,迁徙至西欧,然后前往西部和南部非洲。C. c. rogersi繁殖于西伯利亚的楚科奇半岛,并在东澳洲和新西兰过冬。在中国大陆,分布于辽宁、河北、山东、青海、江苏、福建、广东、海南等地。该物种的模式产地在上海。[14][9]体型较小且数量逐渐减少的[15]rogersi(但可能是后来描述的piersmai)在曼纳湾的泥滩和印度东海岸[16]过冬。[17]最近分裂的亚种C. c. piersmai繁殖于新西伯利亚群岛,并在澳大利亚西北部过冬。[18]C. c. roselaari繁殖于西伯利亚的兰格尔岛和阿拉斯加西北部,并似乎在佛罗里达、巴拿马和委内瑞拉过冬。C. c. rufa繁殖于加拿大低北极地区,在南美洲过冬;C. c. islandica则繁殖于加拿大高北极地区及格陵兰,并在西欧过冬。
在西非过冬的鸟类被发现每天的觅食活动仅限于2—16 km2(0.77—6.18 sq mi)的潮间带范围内,并在一个地点栖息数月。在像瓦登海这样的温带地区,它们每周会更换栖地,觅食范围在一周内可能达到800 km2(310 sq mi)。[19]
B95,也被称为月鸟,是C. c. rufa亚种一个著名的个体。它是一只雄鸟,因其极长的寿命而在保育界闻名——截至2014年5月的最后一次观察时,它至少已经20岁了。[20]
描述与解剖
编辑成年的红腹滨鹬是第二大的Calidris滨鹬,体长约23—26 cm(9.1—10.2英寸),翼展为47—53 cm(19—21英寸)。其体型典型于该属,具有小头和眼睛,短颈和稍微逐渐变细的喙,喙的长度不超过头部。[21]它有短的黑色腿和中等细的黑色喙。冬季或基本羽毛呈现均匀的浅灰色,两性相似。替代或繁殖羽在背部为灰色斑驳,脸部、喉咙和胸部为肉桂色,后腹部为浅色。雌鸟的替代羽毛与雄鸟相似,但略为浅色,眼线不那么明显。Canutus、islandica和piersmai是“较暗”的亚种。亚种rogersi的腹部比roselaari或piersmai更浅,而rufa则是整体羽色最浅的。从替代羽毛到非繁殖羽的过渡始于繁殖地,但在向南迁徙期间最为明显。向北迁徙至繁殖地的迁徙期间主要进行从非繁殖羽到替代羽毛的换羽。[21]
它的体型较大,白色翼条以及灰色臀部和尾巴使其在飞行中容易识别。觅食时,短而深绿色的腿使它呈现出一种“低悬”的特征外观。单独觅食时,它们很少发出叫声,但在群体飞行时,会发出低沉的单音节knutt,而在迁徙时则发出双音节knuup-knuup。它们在6月至8月间于潮湿的苔原上繁殖。雄鸟的展示歌声为一种笛音poor-me。展示行为包括高空盘旋,伴随着翅膀颤抖拍动,并以翅膀向上举起的姿势翻滚至地面。两性共同孵卵,但雌鸟在孵化后将育雏工作交给雄鸟。[3]
幼鸟在第一年具有显著的次边缘线和棕色覆羽。在繁殖季节,雄鸟可以根据红色腹部延伸至后腹的更均匀阴影(相比于分子方法<80%的准确度[22])来区分。[3]
体重因亚种而异,但范围在100、200 g(3.5、7.1 oz)之间。红腹滨鹬在迁徙前可以将体重增加一倍。像许多迁徙鸟类一样,它们在迁徙前也会缩小消化器官的大小。由于迁徙过程中有更多的觅食机会,红腹滨鹬的消化器官萎缩程度不如像斑尾鹬这样的物种那么显著。[23]红腹滨鹬还能够随季节改变消化器官的大小。在冬季觅食地,当进食较硬的食物时,砂囊的厚度增加,而在繁殖地进食较软的食物时,砂囊的大小减小。这些变化可以非常迅速,在短短六天内发生。[24][25]
行为
编辑饮食和觅食
编辑在繁殖地,红腹滨鹬主要吃蜘蛛、节肢动物、幼虫,以及一些透过表面啄食获得的植物材料;在越冬和迁徙地,它们吃各种硬壳猎物,如双壳纲(包括贻贝)、[26]腹足纲和小螃蟹,它们会整个吞下并由强壮的胃来压碎。[21]
在冬季和迁徙期间,红腹滨鹬在泥滩上觅食时是触觉觅食者,它们会在泥中探寻看不见的猎物。它们的觅食技术包括在沿海岸行走时用浅探针探入泥中。当潮水退去时,它们倾向于在表面啄食,而在柔软的泥中,它们可能会将喙插入约1 cm(0.39英寸)的深度进行探测和耕犁。双壳类白樱蛤属(Macoma)软体动物是它们在欧洲海岸的首选猎物,它们整个吞下并在砂囊中将其分解。[27][28]在德拉瓦湾,它们大量以鲎的卵为食,这是一种富含营养且易于消化的食物来源,正好在它们春季到达时鲎会产卵。[29][30]它们能够通过喙上的赫布斯氏小体感知水压变化来探测埋在湿沙下的软体动物。[31]与许多触觉觅食者不同的是,它们的视野并非全景式(允许接近360度的视野),因为在短暂的繁殖季节中,它们转而成为视觉猎食者,通过啄食来获得行动迅速且未隐藏的猎物。[32]啄食也被用来在越冬和迁徙的觅食地获得一些表面食物,例如美洲鲎的卵。[21]
繁殖
编辑红腹滨鹬是领域性动物且具有季节性一夫一妻制;尚不清楚配偶是否会从一个繁殖季节延续到下一个。繁殖于俄罗斯的雄性和雌性已显示出对其繁殖地点的领域忠诚,年复一年地回到相同地点,但目前尚无证据显示它们对领域具有忠诚性。雄鸟比雌鸟早迁徙抵达,并开始捍卫领土。雄鸟一到达就开始展示和积极地捍卫其领土免受其他雄鸟的侵扰。[21]
红腹滨鹬的巢筑于地面,靠近水域,通常位于内陆。它的鸟巢是一个浅的凹陷,内衬叶子、地衣和苔藓。[13]雄鸟在雌鸟到达之前,在其领地内建造三到五个巢穴。雌鸟通常会产下三颗或多于三颗的卵,通常是四颗,产卵过程可能持续六天。卵的大小为43 mm × 30 mm(1.7英寸 × 1.2英寸),颜色为浅橄榄色至深橄榄黄褐色,并带有些微光泽。双亲共同孵卵,平等分担责任。未在当班的亲鸟会与同种其他鸟类一起成群觅食。孵卵期约为22天。在孵卵初期,成鸟会因人类接近巢穴而轻易地被惊动飞离,且在惊飞后可能数小时不会返回巢穴。然而,在孵卵后期,它们会坚守在卵上。 通常,卵的孵化是同步的。雏鸟在孵化时是早熟的,覆盖着隐蔽色的绒毛羽毛。雏鸟和亲鸟会在孵化后一天内离开巢穴,并开始与亲鸟一起觅食。雌鸟会在幼鸟羽翼未丰前离开,而雄鸟则会留下来。幼鸟羽翼丰满后,雄鸟开始向南迁徙,而幼鸟则独自完成首次迁徙。[21]
与鲎的关系
编辑停留地点与食物供应
编辑作为“动物界中迁徙距离最长的物种之一”,红腹滨鹬每年在迁徙路线上依赖相同的停留地点来补充体力,以完成往返繁殖地的迁徙。[33]红腹滨鹬"以比大多数滨鸟更大的群体”飞行,“每年(北半球)春天从南到北飞行 9300 英里,每年秋天则反向重复这一旅程”[33] 北半球的冬季它们在南美洲的火地岛度过,迁徙路线通向北极圈以上的岛屿和大陆上的繁殖地,这些地点只有在短暂的北极夏季才能到达。[33]这些长途旅行被分成大约每段1500英里的路程,每段路程的终点是每年都会拜访的集结区域。具体而言,德拉瓦湾是红腹滨鹬最重要的迁徙休息站,因为它们的生理需求在迁徙期间主要通过食用丰富的鲎卵来满足。红腹滨鹬与鲎之间的关系在进化上是紧密相连的,因为“它们的到来正好与德拉瓦湾每年鲎的产卵期吻合”。[33]数据支持这样的假设,即德拉瓦湾等海滩上鲎卵的丰富度推动了红腹滨鹬的迁徙和分布,而德拉瓦湾中鲎的数量决定了该地点对它们迁徙路线的重要性/相关性。[34]美国的其他停留点包括马萨诸塞州、维吉尼亚州、南卡罗来纳州和乔治亚州的海岸岛屿。较少数的红腹滨鹬进行内陆迁徙,并在墨西哥湾沿岸越冬。这条路线上的停留区域位于密西西比河流域、美国北部的盐湖和加拿大南部的平原。[35]
依赖鲎卵作为食物来源
编辑红腹滨鹬在迁徙前会经历各种生理变化,以应对长途旅行的体力需求:“飞行肌肉质量增加,而腿部肌肉质量减少。胃和砂囊的质量减少,而脂肪质量增加超过50%。”它们到达停留地时极为消瘦。[33]由于砂囊在迁徙期间缩小,它们摄取的硬质食物较少,而是偏好柔软且营养丰富的鲎卵作为食物来源。[33]由于迁徙时间与鲎卵的释放同步,这些特定停留地点的鲎卵广泛存在,使得这一资源容易找到且易于消化,从而节省了鸟类的能量。[33]因此,这些特定地点鲎卵的丰富度和可得性证明了它们之间紧密的关系。红腹滨鹬在停留期间的体重可能会增加一倍,在大约10-14天的停留时间内不断摄食,以增加足够的体脂来继续余下的旅程。[33]居住在德拉瓦湾的大量鲎群体使该地成为红腹滨鹬迁徙中最重要的停留栖地,每年支持着估计50%到80%的迁徙中的红腹滨鹬。[35]
由于鲎卵丰富度与红腹滨鹬生存率之间的相互关联性,鲎群体的健康在讨论红腹滨鹬种群波动和成功方面变得越来越重要。鲎在20世纪初被捕捞用于制作肥料和饲料,现在美国的渔业公司则用它们作为诱饵。[36]鲎的数量受到影响,而红腹滨鹬的数量“在火地岛(冬季)和德拉瓦湾(春季)从1980年代到2000年代下降了约75%”。[35] 1990年代的过度捕捞促使大西洋州海洋渔业委员会采取行动管理鲎的数量,建立了“州际强制捕捞配额,并在德拉瓦湾口设立了1,500平方英里的Carl N. Shuster Jr.鲎保护区”。[36] 随后,鲎诱饵的商业用途已透过数量管理和创新诱饵保护技术得到减少,并且也记录到红腹滨鹬数量的稳定化趋势。[36]
现状
编辑红腹滨鹬的分布范围广泛,估计约为100,000—1,000,000 km2(39,000—386,000 sq mi),总数约为110万只。该物种的种群下降速度未达到IUCN红色名录的门槛(即十年或三代内下降超过30%),因此被评估为“无危”。[1]然而,许多地方的种群下降已经被注意到,例如为了食用而对潮间带平原进行挖掘的活动(欧洲鸟尾蛤),导致了荷兰瓦登海(Dutch Wadden Sea)越冬红腹滨鹬的减少。[37]迁徙停留地点的食物质量是其迁徙策略中的关键因素。[38]
这是非欧亚迁移性水鸟协定(AEWA)(AEWA)适用的物种之一。[39]这要求签署国对列名物种或其卵的采集进行规范,建立保护区以保护列名物种的栖地,规范狩猎,并监测相关鸟类的种群。[40]
红腹滨鹬的种群在近年来似乎已经稳定下来,尽管数量仍然很低。[30]
威胁
编辑红腹滨鹬的种群受到气候变化的极大影响,因为中高纬度的北极栖地对其繁殖至关重要。[33]红腹滨鹬在高纬度和沿海地区繁殖和越冬,而这些地区最容易受到气候变化的影响。巢址通常位于苔原靠近水体的开阔地上。[41]雄性红腹滨鹬在“通常干燥的、石质的苔原高地上准备3-5个巢址,这些地点通常靠近山脊且不远处有湿地”。[42]因此,海平面上升、海岸侵蚀和全球变暖导致的温度升高,破坏了红腹滨鹬在这些北极沿海地区的理想繁殖栖地。迁徙动物本身已经适应了多种环境,然而,对于红腹滨鹬来说,气候变化的迅速和复杂反应对其进化造成了损害。随着北极繁殖地继续变暖,红腹滨鹬的体型减少,且出生于较暖年份的鸟类生存成功率较低。更显著的是,它们在热带的越冬区域变得更为稳定,导致鸟类的喙较短(这可能是因为稳定的条件培养出更大的生态成功率,物种内部的变异性较小)。因此,红腹滨鹬在寻找主要食物来源时变得更加困难,因为这些食物包括深埋的软体动物,这增加了获取食物的困难性和能量消耗。[34]
间接威胁包括鲎的过度捕捞和气候变化,这些都对红腹滨鹬的种群构成了巨大威胁。尽管气候变化等问题可能难以立即或直接改变,但限制鲎的捕捞和减少人类干扰以保护红腹滨鹬的食物来源以及迁徙/繁殖地点,仍是有效的保护措施。[33]
保育努力
编辑2003年,科学家预测按照当时的下降速度,美洲亚种rufa可能会在2010年左右灭绝,但截至2011年4月,该亚种仍然现存。在新泽西州,州和地方机构正在通过限制鲎的捕捞和限制海滩进入来保护这些鸟类。在德拉瓦州,曾颁布了为期两年的鲎捕捞禁令,但后来被法官以证据不足以证明对渔业产生潜在破坏为由推翻,然而近年来已实行只捕捞雄性鲎的政策。[43]
2014年秋末,红腹滨鹬rufa亚种被列为美国《濒危物种法》下的联邦受威胁物种[35][44],这是亚种可以获得的第二严重的保护状态。这是在环保组织经过十年密集请愿后,并对美国内政部提起诉讼,指控其在保护濒危物种方面存在疏忽,未能及时评估和列入保护名单后达成的。将红腹滨鹬rufa亚种列入名单的原因多种多样;栖地退化、关键食物来源的丧失以及气候变化和海平面上升所带来的威胁,都是在将其列入保护名单时考虑的因素。[35]
参考文献
编辑- ^ 1.0 1.1 BirdLife International. Calidris canutus. The IUCN Red List of Threatened Species. 2018, 2018: e.T22693363A132285482 [13 November 2021]. doi:10.2305/IUCN.UK.2018-2.RLTS.T22693363A132285482.en .
- ^ 2.0 2.1 中国科学院动物研究所. 红腹滨鹬. 《中国动物物种编目数据库》. 中国科学院微生物研究所. [2009-04-04]. (原始内容存档于2016-03-05).
- ^ 3.0 3.1 3.2 Marchant, John; Hayman, Peter; Prater, Tony. Shorebirds: an identification guide to the waders of the world. Boston: Houghton Mifflin. 1986: 363–364. ISBN 0-395-37903-2.
- ^ Linnaeus, Carl. Systema naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis. Tomus I. Editio decima, reformata.. Holmiae. (Laurentii Salvii). 1758: 149 (拉丁语).
T. roftro laevi, pedibus cinerascentibus, remigibus primoribus ferratis.
- ^ Holloway, Joel Ellis. Dictionary of Birds of the United States: Scientific and Common Names. Portland, Oregon: Timber Press. 2003: 50 [2024-09-03]. ISBN 0-88192-600-0. (原始内容存档于2022-10-11).
- ^ Knot. 牛津英语词典 (第三版). 牛津大学出版社. 2005-09 (英语).
- ^ Higgins, Peter J.; Davies, S.J.J.F. (编). Handbook of Australian, New Zealand and Antarctic Birds Vol. 3: Snipe to Pigeons. Melbourne, Victoria: Oxford University Press. 1996: 224–232. ISBN 0-19-553070-5.
- ^ 8.0 8.1 Buehler, Deborah M.; Baker, Allan J.; Piersma, Theunis. Reconstructing palaeoflyways of the late Pleistocene and early Holocene Red Knot Calidris canutus (PDF). Ardea. 2006, 94 (3): 485–498 [2024-09-03]. (原始内容存档 (PDF)于2011-07-24).
- ^ 9.0 9.1 Piersma, T.; van Gils, J.; Wiersma, P. Scolopacidae (Sandpipers and Allies). Josep, del Hoyo; Andrew, Sargatal; Jordi, Christie (编). Handbook of the Birds of the World Volume 3, Hoatzin to Auks. Barcelona: Lynx Edicions. 1996: 519. ISBN 84-87334-20-2.
- ^ Thomas, Gavin H.; Wills, Matthew A.; Székely, Tamás. A supertree approach to shorebird phylogeny. BMC Evolutionary Biology. 2004, 4 (28): 1–18. PMC 515296 . PMID 15329156. doi:10.1186/1471-2148-4-28 .
- ^ Gill, F.; Donsker, D. (编). IOC World Bird List 4.2. IOC World Bird List. 2014 [2024-09-03]. doi:10.14344/IOC.ML.4.2 . (原始内容存档于2017-11-04).
- ^ Buehler, Deborah M.; Baker, Allan J. Population divergence times and historical demography in red knots and dunlins (PDF). The Condor. 2005, 107 (3): 497–513. S2CID 34914405. doi:10.1650/0010-5422(2005)107[0497:PDTAHD]2.0.CO;2. hdl:11370/49d5a0f0-de3d-4b3f-801c-4627f769bb00 . (原始内容 (PDF)存档于2011-05-26).
- ^ 13.0 13.1 Red Knot Fact Sheet. www.lpzoo.org]. Lincoln Park Zoo. [2024-09-03]. (原始内容存档于2011-09-29).
- ^ 中国科学院动物研究所. 红腹滨鹬普通亚种. 《中国动物物种编目数据库》. 中国科学院微生物研究所. [2009-04-04]. (原始内容存档于2016-03-05).
- ^ Boere, G.C.; Galbraith, C.A.; Stroud, D.A. (编). Waterbirds around the world (PDF). Edinburgh, UK: The Stationery Office. 2006 [2024-09-03]. (原始内容存档 (PDF)于2011-03-04).
- ^ Rao, P.; Mohapatra, K.K. Occurrence of the Knot (Calidris canutus) in Andhra Pradesh in India. Journal of the Bombay Natural History Society. 1993, 90 (3): 509 [2024-09-03]. (原始内容存档于2024-09-03).
- ^ Balachandran, S. Population, status, moult, measurements, and subspecies of Knot Calidris canutus wintering in south India (PDF). Wader Study Group Bulletin. 1998, 86: 44–47 [2024-09-03]. (原始内容存档 (PDF)于2024-09-03).
- ^ Tomkovich, P.S. A new subspecies of Red Knot Calidris canutus from the New Siberian Islands. Bulletin of the British Ornithologists' Club. 2001, 121: 257–263 [2024-09-03]. (原始内容存档于2024-09-03).
- ^ Leyrer, Jutta; Spaans, Bernard; Camara, Mohamed; Piersma, Theunis. Small home ranges and high site fidelity in red knots (Calidris c. canutus) wintering on the Banc d'Arguin, Mauritania (PDF). Journal of Ornithology. 2006, 147 (2): 376–384 [2024-09-03]. S2CID 8361259. doi:10.1007/s10336-005-0030-8. (原始内容存档 (PDF)于2011-07-24).
- ^ Bauers, Sandy. Globe-spanning bird B95 is back for another year. The Philadelphia Inquirer. [2 June 2014]. (原始内容存档于2015-09-19).
- ^ 21.0 21.1 21.2 21.3 21.4 21.5 Baker, Allan; Gonzalez, Patricia; Morrison, R.I.G.; Harrington, Brian A. Poole, A. , 编. Red Knot (Calidris canutus). The Birds of North America Online (Ithaca: Cornell Lab of Ornithology). 2013 [27 April 2009]. doi:10.2173/bna.563.
- ^ Baker, A.J.; Piersma, T.; Greenslade, A.D. Molecular vs. phenotypic sexing in red knots (PDF). The Condor (Cooper Ornithological Society). 1999, 101 (4): 887–893 [2024-09-03]. JSTOR 1370083. doi:10.2307/1370083. hdl:11370/35e84bea-180f-402a-9875-ddceb3ee086f . (原始内容存档 (PDF)于2024-09-03).
- ^ Piersma, Theunis. Phenotypic Flexibility during Migration: Optimization of Organ Size Contingent on the Risks and Rewards of Fueling and Flight?. Journal of Avian Biology (Blackwell Publishing). 1998, 29 (4): 511–520 [2024-09-03]. JSTOR 3677170. doi:10.2307/3677170. hdl:11370/910b3b48-babf-45ec-aeaf-d62399e5662f . (原始内容存档于2020-09-23).
- ^ Dekinga, A.; Dietz, M.W.; Koolhaas, A.; Piersma, T. Time course and reversibility of changes in the gizzards of red knots alternately eating hard and soft food (PDF). Journal of Experimental Biology. 2001, 204 (12): 2167–2173. PMID 11441058. doi:10.1242/jeb.204.12.2167.
- ^ Piersma, Theunis; Dietz, M.W.; Dekinga, A.; Nebel, S.; van Gils, J.A.; Battley, P.F.; Spaans, B. Reversible size-changes in stomachs of shorebirds: when, to what extent, and why? (PDF). Acta Ornithologica. 1999, 34: 175–181. (原始内容 (PDF)存档于2011-06-10).
- ^ Avery, J. (2011). Calidris canutus rufa (页面存档备份,存于互联网档案馆), Animal Diversity Web
- ^ Prater, A.J. The Ecology of Morecambe Bay. III. The Food and Feeding Habits of Knot (Calidris canutus L.) in Morecambe Bay. Journal of Applied Ecology (British Ecological Society). 1972, 9 (1): 179–194. Bibcode:1972JApEc...9..179P. JSTOR 2402055. doi:10.2307/2402055.
- ^ Zwarts, L.; Blomert, A-M. Why knot Calidris canutus take medium-sized Macoma balthica when six prey species are available (PDF). Marine Ecology Progress Series. 1992, 83 (2–3): 113–128 [2024-09-03]. Bibcode:1992MEPS...83..113Z. doi:10.3354/meps083113 . (原始内容存档 (PDF)于2020-09-23).
- ^ Petition to List the Red Knot (Caladris canutus rufa) as Endangered and Request for Emergency Listing under the Endangered Species Act (PDF). Federal Wildlife Service. 2 August 2005 [27 March 2009]. (原始内容存档 (PDF)于2009-01-16).
- ^ 30.0 30.1 Northeast Region, U.S. Fish and Wildlife Service. fws.gov. [2020-03-03]. (原始内容存档于2022-02-18).
- ^ Piersma, Theunis; van Aelst, Renee; Kurk, Karin; Berkhoudt, Herman; Maas, Leo R.M. A new pressure sensory mechanism for prey detection in birds: the use of principles of seabed dynamics? (PDF). Proceedings of the Royal Society B: Biological Sciences. 1998, 265 (1404): 1377–1383. PMC 1689215 . doi:10.1098/rspb.1998.0445. (原始内容 (PDF)存档于2004-06-23).
- ^ Martin, Graham R.; Piersma, Theunis. Vision and touch in relation to foraging and predator detection: insightful contrasts between a plover and a sandpiper. Proceedings of the Royal Society B. 2009, 276 (1656): 437–445. PMC 2664340 . PMID 18842546. doi:10.1098/rspb.2008.1110.
- ^ 33.00 33.01 33.02 33.03 33.04 33.05 33.06 33.07 33.08 33.09 Red Knot (Calidris canutus) (页面存档备份,存于互联网档案馆). U.S. Fish and Wildlife Service.
- ^ 34.0 34.1 Van Gils, Jan A.; Lisovski, Simeon; Lok, Tamar; Meissner, Włodzimierz; Ożarowska, Agnieszka; De Fouw, Jimmy; Rakhimberdiev, Eldar; Soloviev, Mikhail Y.; Piersma, Theunis; Klaassen, Marcel. Body shrinkage due to Arctic warming reduces red knot fitness in tropical wintering range (PDF). Science. 2016, 352 (6287): 819–821 [2024-09-03]. Bibcode:2016Sci...352..819V. PMID 27174985. S2CID 206644249. doi:10.1126/science.aad6351. (原始内容存档 (PDF)于2022-10-11).
- ^ 35.0 35.1 35.2 35.3 35.4 Rufa Red Knot (页面存档备份,存于互联网档案馆). USFWS Northeast Region Division of External Affairs. Northeast Region, U.S. Fish and Wildlife Service.
- ^ 36.0 36.1 36.2 The Horseshoe Crab Limulus polyphemus A Living Fossil (页面存档备份,存于互联网档案馆). U.S. Fish & Wildlife Service. February 2004
- ^ van Gils, Jan A.; Piersma, Theunis; Dekinga, Anne; Spaans, Bernard; Kraan, Casper. Shellfish Dredging Pushes a Flexible Avian Top Predator out of a Marine Protected Area. PLOS Biology. 2006, 4 (12): e376. PMC 1635749 . PMID 17105350. doi:10.1371/journal.pbio.0040376 .
- ^ van Gils, Jan A.; Battley, Phil F.; Piersma, Theunis; Drent, Rudi. Reinterpretation of gizzard sizes of red knots world-wide emphasises overriding importance of prey quality at migratory stopover sites. Proceedings of the Royal Society B. 2005, 272 (1581): 2609–2618. PMC 1559986 . PMID 16321783. doi:10.1098/rspb.2005.3245.
- ^ Annex 2: Waterbird species to which the Agreement applies (PDF). Agreement on the conservation of African-Eurasian migratory Waterbirds (AEWA). AEWA. [22 April 2008]. (原始内容 (PDF)存档于2007-11-10).
- ^ Annex 3: Waterbird species to which the Agreement applies (PDF). Agreement on the conservation of African-Eurasian migratory Waterbirds (AEWA). AEWA. [22 April 2008]. (原始内容 (PDF)存档于10 August 2011).
- ^ “Red Knot.” (页面存档备份,存于互联网档案馆) Audubon.
- ^ Red Knot Life History (页面存档备份,存于互联网档案馆). All About Birds, Cornell Lab of Ornithology.
- ^ ASMFC Horseshoe Crab and Delaware Bay Ecosystem Technical Committees Meeting (PDF). Atlantic States Marine Fisheries Commission. [25 June 2019]. (原始内容存档 (PDF)于2024-06-30).
- ^ Species Profile for Red Knot (Calidris canutus ssp. rufa). ecos.fws.gov. (原始内容存档于2011-10-19).
| 这是一篇鸻形目相关小作品。您可以通过编辑或修订扩充其内容。 |