缓激肽
缓激肽(英语:Bradykinin)是引起血管扩张的一种肽,因此导致血压降低。一类名叫ACE抑制药的用于降血压的药物会增加缓激肽的浓度(通过抑制其降解)进而降低血压。缓激肽是通过释放前列环素、一氧化氮以及内皮衍生的超极化因子作用于血管的。
| 缓激肽 | |
|---|---|
| |
| |
| 识别 | |
| CAS号 | 58-82-2 |
| PubChem | 439201 |
| ChemSpider | 388341 |
| SMILES |
|
| InChI |
|
| InChIKey | QXZGBUJJYSLZLT-FDISYFBBBG |
| ChEBI | 3165 |
| MeSH | Bradykinin |
| IUPHAR配体 | 649 |
| 性质 | |
| 化学式 | C50H73N15O11 |
| 摩尔质量 | 1060.21 g/mol g·mol⁻¹ |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
| 激肽原1 | |
|---|---|
| 识别 | |
| 符号 | KNG1 |
| 替换符号 | KNG, BDK |
| Entrez | 3827 |
| HUGO | 6383 |
| OMIM | 612358 |
| RefSeq | NM_001102416 |
| UniProt | P01042 |
| 其他资料 | |
| 基因座 | 3 q21-qter |
| 缓激肽 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 鉴定 | |||||||||
| 标志 | 缓激肽 | ||||||||
| Pfam | PF06753(旧版) | ||||||||
| InterPro | IPR009608 | ||||||||
| |||||||||
结构
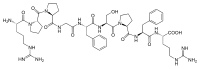
编辑缓激肽是一种含有九个氨基酸的肽链。缓激肽的氨基酸序列是 Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg (RPPGFSPFR)。其化学式为C50H73N15O11。
合成
编辑激肽-激肽释放酶系统通过溶蛋白性裂解其激肽原前体而产生出缓激肽,这里的激肽原前体是高分子量激肽原(HMWK或HK),完成此过程的酶为激肽释放酶。
代谢
编辑在人体中,缓激肽被三种激肽酶降解:血管紧张素转化酶(ACE)、氨肽酶P(APP)以及羧肽酶N(CPN),他们分别切割7~8、1~2和8~9号位肽键[1][2]。
生理学作用(功能)
编辑效应
编辑缓激肽是一种强大的内皮依赖性血管舒张剂,会导致非血管的平滑肌收缩,增加血管通透性并且亦涉及到疼痛的机制。缓激肽也会导致尿钠增多,有助于降低血压。
缓激肽会使新皮质的星形胶质细胞内部钙离子水平升高,致使它们释放谷氨酸[3]。
在某些使用血管紧张素Ⅰ转化酶(ACE)抑制药的病人中,缓激肽被认为是导致干咳的诱因。这种难以治疗的咳嗽通常是由于停止ACE抑制药的治疗而导致的。在此种情况下,血管紧张素Ⅱ受体拮抗剂被用于下一步治疗。
缓激肽的活性过高被认为在一种名叫遗传性血管性水肿的罕见疾病中扮演了角色,这种病曾被称为遗传性血管-神经水肿[4]。
分娩后婴儿首次分泌的缓激肽会导致动脉导管收缩并最终使其退化,形成肺动脉干与主动脉弓之间的动脉韧带。
受体
编辑- B1受体(亦称为缓激肽受体B1)仅在作为组织受伤的结果下被表达,并推测其在慢性疼痛之中起作用。亦发现这一受体在炎症反应中起到作用[5]。最近,现已表明激肽B1受体会通过产生趋化因子CXCL5而招募嗜中性粒细胞。此外,现发现内皮细胞是这一B1受体-CXCL5通路的潜在来源[6]。
- The B2受体是组成型表达产物且参与缓激肽的血管舒张作用。
激肽B1与B2受体属于G蛋白偶联受体(GPCR)家族。
历史
编辑缓激肽于1948年由三名工作于Maurício Rocha e Silva领导的巴西圣保罗生物学会中巴西生理学家与药理学家发现的。
用于治疗的可能性
编辑另见
编辑参考文献
编辑- ^ Dendorfer A, Wolfrum S, Wagemann M, Qadri F, Dominiak P. Pathways of bradykinin degradation in blood and plasma of normotensive and hypertensive rats. Am. J. Physiol. Heart Circ. Physiol. May 2001, 280 (5): H2182–8. PMID 11299220.
- ^ Kuoppala A, Lindstedt KA, Saarinen J, Kovanen PT, Kokkonen JO. Inactivation of bradykinin by angiotensin-converting enzyme and by carboxypeptidase N in human plasma. Am. J. Physiol. Heart Circ. Physiol. April 2000, 278 (4): H1069–74. PMID 10749699.
- ^ Parpura V, Basarsky TA, Liu F, Jeftinija K, Jeftinija S, Haydon PG. Glutamate-mediated astrocyte-neuron signalling. Nature. June 1994, 369 (6483): 744–7. PMID 7911978. doi:10.1038/369744a0.
- ^ Bas M, Adams V, Suvorava T, Niehues T, Hoffmann TK, Kojda G. Nonallergic angioedema: role of bradykinin. Allergy. August 2007, 62 (8): 842–56. PMID 17620062. doi:10.1111/j.1398-9995.2007.01427.x.
- ^ McLean PG, Ahluwalia A, Perretti M. Association between Kinin B1 Receptor Expression and Leukocyte Trafficking across Mouse Mesenteric Postcapillary Venules. J. Exp. Med. August 2000, 192 (3): 367–80. PMC 2193221 . PMID 10934225. doi:10.1084/jem.192.3.367.
- ^ Duchene J, Lecomte F, Ahmed S, Cayla C, Pesquero J, Bader M, Perretti M, Ahluwalia A. A novel inflammatory pathway involved in leukocyte recruitment: role for the kinin B1 receptor and the chemokine CXCL5. J. Immunol. October 2007, 179 (7): 4849–56. PMID 17878384.