烟酰胺腺嘌呤二核苷酸
烟酰胺腺嘌呤二核苷酸(英语:nicotinamide adenine dinucleotide,NAD[1][2])简称辅酶Ⅰ,是脱氢酶的辅酶,作为氧化作用中的电子载体,氧化底物时其分子中的烟酰胺环接受一个氢离子和两个电子[3][4]。
| 烟酰胺腺嘌呤二核苷酸 | |
|---|---|
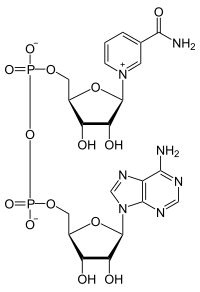
| |

| |
| 识别 | |
| CAS号 | 53-84-9 58-68-4 |
| PubChem | 925 |
| ChemSpider | 5681 |
| InChI |
|
| InChIKey | BAWFJGJZGIEFAR-NNYOXOHSBR |
| ChEBI | 16908 |
| RTECS | UU3450000 |
| DrugBank | DB00157 |
| KEGG | C00003 |
| MeSH | Nicotinamide-Adenine+Dinucleotide |
| IUPHAR配体 | 2451 |
| 性质 | |
| 化学式 | C21H27N7O14P2 |
| 摩尔质量 | 663.425 g·mol⁻¹ |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
NAD由两个核苷酸组成,所以叫二核苷酸,一个含有腺嘌呤,另一种含有烟酰胺,这两个核苷酸通过焦磷酸盐连接在一起。NAD 以两种形式存在:氧化形式的NAD+和还原形式的NADH。NADH最多可携带两个质子(写为NADH + H+)。NAD作为一种可以转递质子(更准确来说是氢离子)的辅酶,出现在细胞很多代谢反应中[5]。

NAD+是脱氢酶的辅酶,如乙醇脱氢酶(ADH),用于氧化乙醇。它在糖酵解、糖异生、三羧酸循环及呼吸链中发挥着不可替代的作用。中间产物会将脱下的氢递给NAD+,使之成为 NADH + H+。
而 NADH + H+ 则会作为氢的载体,在电子传递链中通过化学渗透偶联的方式,合成ATP。
生化性质
编辑在吸光方面,NADH在260nm和340nm处各有一吸收峰,而NAD+则只有260nm一处吸收峰,这是区别两者的重要属性。这同时也是很多代谢试验中,测量代谢率的物理依据。NAD在260nm的摩尔吸光度为1.78x104L /(mol·cm),而NADH在340nm的摩尔吸光度为6.2x103 L/(mol·cm)。
在生物体内中,NAD可以由简单的构建块与氨基酸色氨酸或天冬氨酸合成。以替代方式,将更复杂的酶组合从食物中摄取,这维生素被称为烟酸。通过分解NAD结构的反应释放相似的化合物。这些预制组件然后通过一个回收通道,将其回收成活性形式。一些NAD也转化为烟酰胺腺嘌呤二核苷酸磷酸(NADP);这种相关辅酶的化学成分与NAD类似,但在新陈代谢中具有不同的作用。
在代谢中,NAD+参与氧化还原反应,将电子从一个反应携带到另一个反应。因此,辅酶在细胞中以两种形式存在:NAD+是一种氧化剂,能接受来自其他分子的电子。该反应形成NADH,然后又可以用作为还原剂来给电子。这些电子转移反应是NAD的主要功能。然而,它也用于其他细胞过程中,最显著的是添加或除去蛋白质中的化学基团的酶的底物。由于这些功能的重要性,发现NAD代谢的酶是药物的目标。尽管NAD+在特定氮原子上的正电荷而被写入上标加号,但在生理pH大部分情况下,实际上是单电荷的阴离子(负电荷为1),而NADH为双电荷阴离子。
历史
编辑辅酶NAD+首先由英国生物化学家亚瑟·哈登和威廉·约翰·杨在1906年发现。他们注意到添加煮沸和过滤的酵母提取物大大加速了未煮沸的酵母提取物中的酒精发酵。他们将产生这个效应的不明因子称为“辅酵(coferment)”[6],其后科学家改称辅酶(coenzyme)。通过酵母提取物的长期和困难的纯化,该热稳定因子被欧勒切尔匹称为一种“核苷酸糖磷酸盐”(nucleotide sugar phosphate)[7]。1936年,德国科学家奥托·海因里希·沃堡表明核苷酸辅酶在氢化物转移中的功能,并将烟酰胺部分鉴定为氧化还原反应的位点[8]。
细胞中的浓度和状态
编辑在大鼠肝脏中,NAD+和NADH的总量约为每克湿重约1微摩尔,约为相同细胞中NADP+和NADPH浓度的10倍。[9]细胞溶质中NAD+的实际浓度较难测量,最近研究显示在动物细胞中约0.3mM,在酵母菌中约1.0-2.0mM。[10] 然而,线粒体中超过80%的NADH荧光是结合形式,因此溶液中的浓度要低得多。在其他研究细胞中相关数据十分有限,尽管在线粒体中,NAD+的浓度与细胞质中的浓度相似。[11]这种NAD+被特定的膜转运蛋白携带到线粒体中,因为辅酶不能通过薄膜扩散。[12]
氧化还原形式的烟酰胺腺嘌呤二核苷酸之间的平衡称为NAD+ / NADH比。该比例是所谓的细胞的氧化还原状态的重要组成部分,其反映了细胞的代谢活性和健康状况。[13] NAD+ / NADH比例的影响是复杂的,控制了几种关键酶的活性。在健康的哺乳动物组织中,细胞质中游离NAD+和NADH之间的比例通常约为700;该比例因此有利于氧化反应。[14] 总NAD+ / NADH的比例要低得多,哺乳动物的估计范围是3-10。相比之下,NADP+ / NADPH比通常约为0.005,因此NADPH是该辅酶的主要形式。这些不同的比例是NADH和NADPH不同代谢作用的关键。
生物合成
编辑合成
编辑NAD+通过两种代谢途径合成:通过组合已有的成分如烟酰胺再循环回NAD+,或由氨基酸从头合成。 大多数生物从简单的组分合成NAD+特定的反应集合在生物体之间会有所不同,但是常见的特征是在动物中的氨基酸 - 色氨酸和一些细菌或一些细菌和植物中的天冬氨酸之间产生喹啉酸(QA)。[15]通过转移磷酸二糖部分将喹啉酸转化成烟酸单核苷酸(NaMN)。然后转移腺苷酸部分形成烟酸腺嘌呤二核苷酸(NAD)。最后,NAD中的烟酸部分酰胺化成烟酰胺(Nam)部分,形成NAD+。再进一步,一些NAD+会被NAD+激酶转化成NADP+,磷酸化的NAD+。在大多数生物体中,该酶使ATP作为途径做成磷酸盐基团。尽管几种细菌如结核分枝杆菌和超嗜热古菌使用无机多磷酸作为替代磷酸供体 [16]。
修复途径
编辑除了从简单的氨基酸前体组装NAD+之外,细胞还回收含有吡啶碱的化合物。在这些修补新陈代谢中使用三种维生素前体是烟酸,烟酰胺和安雅核糖。这些化合物可以从饮食中摄取,称为维生素B3或烟酸。然而,这些化合物也在细胞内并通过NAD+的消化而产生。这些补救途径中涉及的一些酶似乎集中在细胞核中,这可能补偿在该细胞器中消耗NAD+的水平。补救反应在人类中是必不可少的;饮食中缺乏烟酸引起维生素缺乏症的皮肤病。[17]由于NAD+在氧化还原反应中,氧化和还原形式之间的循环不会改变辅酶的总体水平,所以NAD+的高要求是由于反应中的辅酶而不断消耗。
微生物使用的补救途径与哺乳动物不同。[18]一些病原体,如酵母假丝酵母和流感嗜血杆菌细菌是NAD+的营养缺陷型,因此导致它们不能合成NAD+不过它们还具有补救用途,因此依赖于外来的NAD+或其他先驱物。更令人惊讶的是细胞内病原体沙眼衣原体,其缺乏NAD+和NADP+的生物合成或任何基因的可识别的候选物,并且必须从其宿主而获得这些辅酶。
作用
编辑NAD+在代谢中具有几个重要的作用。它作为辅酶在氧化还原反应中作为ADP-核糖基化反应中ADP-核糖部分的后体,作为第二信使分子环状ADP-核糖的前体,以及作为细菌DNA连接酶和基团的底物称为沉默的酶,其使用NAD+从蛋白质中除去乙酰基。除了代谢功能之外,NAD+作为腺嘌呤核苷酸出现,可以通过调节机制自发释放细胞,因此可以具有重要的细胞外作用。[19]
NAD+是身体每个细胞中发现的能量提供分子,用于代谢、构建新的细胞、抵抗自由基和DNA损伤,并在细胞内发送信号,它使线粒体将我们吃的食物转化为我们身体需要维持其所有功能的能量。还需要“关闭”加速衰老过程的基因。NAD+对于生命至关重要。健康的线粒体功能,是人类衰老的重要组成部分。我们的身体有能力从我们吃的食物中的组分制成NAD+。实验动物和人群的研究[来源请求]表明,随着年龄的增长,NAD+的水平大幅下降。这种下降使我们面临更大的神经和肌肉退化的风险、心脏代谢健康的下降以及修复和弹性的。著名研究机构的科学家[谁?]一直在研究NAD+增强策略,作为与衰老相关的退化病症的治疗方法[来源请求]。研究[来源请求]表明,NAD+在肌肉和组织保护中起著独特的作用,同时也提高了生命周期。
商业应用
编辑NAD+在中国大陆又名氧化型辅酶Ⅰ,把NADH称为还原型辅酶Ⅰ。香港的保健品市场,以“诺加因子”作为NAD+的中文名字。
参考文献
编辑- ^ Molecule of the Week Archive: Nicotinamide adenine dinucleotide. The American Chemical Society (ACS). [2024-08-22]. (原始内容存档于2024-08-22).
- ^ Karlson, P. Introduction to Modern Biochemistry. Academic Press. 2014-05-12 [2024-08-22]. ISBN 978-1-4832-6778-4. (原始内容存档于2024-08-22) (英语).
- ^ J L Jain; Sunjay Jain, Nitin Jain. Fundamentals of Biochemistry. S. Chand Publishing. 2022: 495–496 [2024-08-22]. ISBN 9789352838301. (原始内容存档于2024-08-22).
- ^ NAD⁺ vs. NADH. [2024-08-22]. (原始内容存档于2024-08-22).
- ^ D M Vasudevan; Sreekumari S, Kannan Vaidyanathan. Textbook of Biochemistry for Medical Students. JP Medical Ltd. 2016: 55 [2024-08-22]. ISBN 9789385999741. (原始内容存档于2024-08-22).
- ^ Harden, A; Young, WJ. The alcoholic ferment of yeast-juice Part II.--The coferment of yeast-juice. Proceedings of the Royal Society of London. Series B, Containing Papers of a Biological Character. 24 October 1906, 78 (526): 369–375. JSTOR 80144. doi:10.1098/rspb.1906.0070 .
- ^ Fermentation of sugars and fermentative enzymes (PDF). Nobel Lecture, 23 May 1930. Nobel Foundation. [2007-09-30]. (原始内容 (PDF)存档于27 September 2007).
- ^ [Warburg O, Christian W (1936). "Pyridin, der wasserstoffübertragende bestandteil von gärungsfermenten (pyridin-nucleotide)" [Pyridin, the hydrogen-transferring component of the fermentation enzymes (pyridine nucleotide)]. Biochemische Zeitschrift (in German). 287: 291. doi:10.1002/hlca.193601901199.]
- ^ [Reiss PD, Zuurendonk PF, Veech RL (1984). "Measurement of tissue purine, pyrimidine, and other nucleotides by radial compression high-performance liquid chromatography". Anal. Biochem. 140 (1): 162–71. doi:10.1016/0003-2697(84)90148-9. PMID 6486402.]
- ^ [Yang H, Yang T, Baur JA, Perez E, Matsui T, Carmona JJ, Lamming DW, Souza-Pinto NC, Bohr VA, Rosenzweig A, de Cabo R, Sauve AA, Sinclair DA (2007). "Nutrient-Sensitive Mitochondrial NAD+ Levels Dictate Cell Survival". Cell. 130 (6): 1095–107. ]
- ^ Yang H, Yang T, Baur JA, Perez E, Matsui T, Carmona JJ, Lamming DW, Souza-Pinto NC, Bohr VA, Rosenzweig A, de Cabo R, Sauve AA, Sinclair DA. Nutrient-Sensitive Mitochondrial NAD+ Levels Dictate Cell Survival. Cell. 2007, 130 (6): 1095–107. PMC 3366687 . PMID 17889652. doi:10.1016/j.cell.2007.07.035.
- ^ [Todisco S, Agrimi G, Castegna A, Palmieri F (2006). "Identification of the mitochondrial NAD+ transporter in Saccharomyces cerevisiae". J. Biol. Chem. 281 (3): 1524–31. doi:10.1074/jbc.M510425200. PMID 16291748.]
- ^ [Schafer FQ, Buettner GR (2001). "Redox environment of the cell as viewed through the redox state of the glutathione disulfide/glutathione couple". Free Radic Biol Med. 30 (11): 1191–212. doi:10.1016/S0891-5849(01)00480-4. PMID 11368918.]
- ^ [Zhang Q, Piston DW, Goodman RH (2002). "Regulation of corepressor function by nuclear NADH". Science. 295 (5561): 1895–7. doi:10.1126/science.1069300. PMID 11847309.]
- ^ [Katoh A, Uenohara K, Akita M, Hashimoto T (2006). "Early Steps in the Biosynthesis of NAD in Arabidopsis Start with Aspartate and Occur in the Plastid". Plant Physiol. 141 (3): 851–7. doi:10.1104/pp.106.081091. PMC 1489895Freely accessible. PMID 16698895.]
- ^ [Raffaelli N, Finaurini L, Mazzola F, Pucci L, Sorci L, Amici A, Magni G (2004). "Characterization of Mycobacterium tuberculosis NAD kinase: functional analysis of the full-length enzyme by site-directed mutagenesis". Biochemistry. 43 (23): 7610–7. doi:10.1021/bi049650w. PMID 15182203.]
- ^ [ Henderson LM (1983). "Niacin". Annu. Rev. Nutr. 3: 289–307. doi:10.1146/annurev.nu.03.070183.001445. PMID 6357238.]
- ^ [Rongvaux A, Andris F, Van Gool F, Leo O (2003). "Reconstructing eukaryotic NAD metabolism". BioEssays. 25 (7): 683–90. doi:10.1002/bies.10297. PMID 12815723.]
- ^ [ Billington RA, Bruzzone S, De Flora A, Genazzani AA, Koch-Nolte F, Ziegler M, Zocchi E (2006). "Emerging functions of extracellular pyridine nucleotides". Mol Med. 12 (11–12): 324–7. doi:10.2119/2006-00075.Billington. PMC 1829198Freely accessible. PMID 17380199]
相关条目
编辑- 烟酰胺腺嘌呤二核苷酸磷酸(NADP+)
- 呼吸作用
外部链接
编辑- NAD bound to proteins (页面存档备份,存于互联网档案馆) in the PDB
- NAD Animation (Flash Required)
- http://www.sigmaaldrich.com/etc/medialib/docs/Sigma/Product_Information_Sheet/2/n8285pis.Par.0001.File.tmp/n8285pis.pdf (页面存档备份,存于互联网档案馆) and NADH (reduced) (页面存档备份,存于互联网档案馆) Chemical data sheet from Sigma-Aldrich
- http://biocyc.org/META/NEW-IMAGE?type=COMPOUND&object=NAD (页面存档备份,存于互联网档案馆), NADH (页面存档备份,存于互联网档案馆) and NAD synthesis pathway (页面存档备份,存于互联网档案馆) at the MetaCyc database
- List of oxidoreductases (页面存档备份,存于互联网档案馆) at the SWISS-PROT database