二磷 编辑
化合物
| 了解更多 此条目翻译品质不佳。 |
二磷是一种无机化合物,化学式P
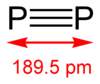
2。磷之上的氮会形成有氮氮三键的N2分子,而磷倾向于形成P4,因为P-Pπ键的能量很高。二磷的结构类似氮气,但反应性很高,键解离能为(117 kcal/mol或490kJ/mol)氮气的一半。二磷的键长为1.8934 Å。[2]
| 二磷 | |||
|---|---|---|---|
| |||
| IUPAC名 Diphosphorus | |||
| 系统名 Diphosphyne[1] | |||
| 识别 | |||
| CAS号 | 12185-09-0 | ||
| PubChem | 5460700 | ||
| ChemSpider | 4574176 | ||
| SMILES | |||
| InChI | |||
| InChIKey | FOBPTJZYDGNHLR-UHFFFAOYAU | ||
| Gmelin | 1400241 | ||
| ChEBI | 33472 | ||
| 性质 | |||
| 化学式 | P2 | ||
| 摩尔质量 | 61.95 g·mol−1 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
制备
编辑将白磷加热至1100 °K(827 °C)可取得二磷。然而,通过一些过渡金属配合物(例如基于钨和铌的配合物),在正常条件下的均相溶液中生成二磷的方面已经取得了一些进展。[3]离解P4分子中的键的方法也被提出过,比如光激发。[4]
参考资料
编辑- ^ Diphosphorus (CHEBI:33472). Chemical Entities of Biological Interest (ChEBI). UK: European Bioinformatics Institute. [2021-01-01]. (原始内容存档于2016-03-04).
- ^ Huber, K. P.; Herzberg, G. Molecular Spectra and Molecular Structure IV. Constants of Diatomic Molecules. New York: Van Nostrand. 1979. ISBN 978-0442233945.
- ^ Piro, Nicholas A.; Figueroa, Joshua S.; McKellar, Jessica T.; Cumnins, Christopher C. Triple-Bond Reactivity of Diphosphorus Molecules. Science. 1 September 2006, 313 (5791): 1276–1279. Bibcode:2006Sci...313.1276P. PMID 16946068. S2CID 27740669. doi:10.1126/science.1129630.
- ^ Lee-Ping Wangb; Daniel Tofana; Jiahao Chena; Troy Van Voorhisa & Christopher C. Cummins. A pathway to diphosphorus from the dissociation of photoexcited tetraphosphorus. RSC Advances (Royal Society of Chemistry). September 2013 [2017-07-21]. (原始内容存档于2017-07-21). (页面存档备份,存于互联网档案馆)
外部链接
编辑- Ron Dagani, "A Mild Route To P2", Chemical & Engineering News September 4, 2006 Link (页面存档备份,存于互联网档案馆)
- Carmen Drahl "Flash Of Phosphorus Chemistry Innovation", Chemical & Engineering News September 13, 2010 Link