双硫键
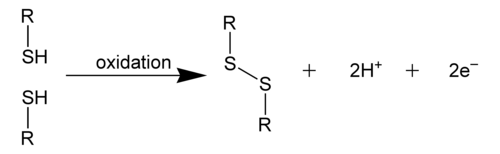
双硫键在化学上是一条从结合硫醇而衍生的单共价键。它又称为二硫键或双硫桥,大部分用于生物化学的范畴。其正式名称应为过硫化物,但却甚少使用。与过氧化物(R-O-O-R)相似,它的整体连结是R-S-S-R。双硫键一般都是从巯基的氧化形成:
三个硫原子按序列连结有时被称为三硫键,但其实只是两个双硫键。双硫键在橡胶的硫化有著重要的地位。
蛋白质
编辑双硫键在一些蛋白质的折叠及稳定性占有重要的地位,而这些蛋白质多是分泌在细胞外的环境。由于大部份细胞的区间都是还原环境,这令在细胞质基质中的双硫键十分不稳定(但亦有例外)。
蛋白质的双硫键是在半胱氨酸残基的硫醇之间形成。其他含有硫的胺基酸——蛋氨酸就不能形成双硫键。一条双硫键一般是将半胱氨酸的简写用连结符号来表示,例如“Cys26-Cys84双硫键”,或简化为“26-84双硫键”,或更简单的“C26-C84”,当中已暗示了双硫键而不须明言。蛋白质双硫键的原型是双胺基酸肽的胱氨酸,它是以双硫键将两个半胱氨酸结合组成。双硫键结构是以它在 原子之间的 两面角来描述,而一般都是接近±90°。
双硫键从以下方式稳定折叠后的蛋白质:
- 它将蛋白质的两部份紧握,使蛋白质形成折叠的形状。另一种说法则是它降低非折叠形状的蛋白质的熵,使其不稳定。
- 它会成为折叠后蛋白质的疏水核心,亦即局部的疏水残基会凝聚在双硫键的周边,透过疏水性的相互作用而紧扣在一起。
- 与1及2有关的,它会与蛋白质链的两段连结,增加蛋白质残基的局部有效浓度,并降低水分子的局部有效浓度。因为水分子会攻击氨基之间的氢键及打破二级结构,双硫键就可以稳定在附近的二级结构。例如,有研究显示肽的不同部份在分隔后没有结构,但在建立双硫键后就有著稳定的二级结构及三级结构。
蛋白质的双硫键是由硫醇双硫交换反应来形成。disulfide species是指半胱氨酸在双硫连接蛋白质中的特定配对,一般会以括号来表示,例如“(26-84, 58-110)disulfide species”。disulfide ensemble则是一组有著相同编号双硫键的disulfide species.并以1S ensemble、2S ensemble等来分别表示有一条、两条等双硫键的disulfide ensemble。因此,(26-84) disulfide species属于1S ensemble,而(26-84, 58-110) species则属于2S ensemble。而没有双硫键的species就会以R来表示,代表完全还原的意思。在一般的情况下,双硫键的重新现置是比形成新双硫键或是它们的还原来得要快。所以,在ensemble中的disulfide species比在 ensemble之间更快获得平衡。
蛋白质的原始形式一般是一个单一的disulfide species,而有些蛋白质在功能上会转变双硫键的状态,例如硫氧还蛋白。在多于两个半胱氨酸的蛋白质中,可以生成非原始的双硫键,而这些蛋白质差不多都是没有折叠的。当半胱氨酸的数量增加时,非原始的蛋白质会以几何级数增加。从n个半胱氨酸生成p条双硫键的方法的数量可以由以下方程式获得:
例如8个半胱氨酸的蛋白质(如核糖核酸酶A)有著105种不同的four-disulfide species,只有一个是原始的disulfide species。异构酶可以催化disulfide species之间的转变,加速形成原始的disulfide species。
有著原始双硫键的Disulfide species是以des及方括号来表示。例如des[40-95] disulfide species就有著除了40及95的半胱氨酸外的所有双硫键。缺乏一条原始双硫键的Disulfide species多是折叠的,尤其是当它暴露于在已折叠及原始的蛋白质中的溶剂。
原核生物
编辑双硫键在细菌中负责重要的保护作用,当细菌暴露于氧化反应时,双硫键可以作为可逆的开关,将蛋白质开启或关闭。若没有双硫键的保护作用,低浓度的过氧化氢就能严重地破坏细菌的DNA及杀死细菌。
真核生物
编辑在真核生物细胞中,双硫键一般是在粗面内质网内生成,而非原生质。这是因内质网的氧化环境及原生质的还原环境(参考谷胱甘肽)。所以双硫键多会在分泌的蛋白质、溶酶蛋白质及膜蛋白质的外浆区域中找到。
但是亦有例外的情况。在原生质的蛋白质附近出现的半胱氨酸残基会成为氧化感应器,当细胞的还原潜能转弱时,它们氧化及触发细胞反应。牛痘病毒亦会产生有著多个双硫键的原生质蛋白质及肽,虽然原因不明,它们有著保护的效力抵抗细胞间的蛋白质加水分解。
毛发
编辑毛发是一种生物聚合体,干重量超过90%是由角质素的蛋白质造成。在正常情况下,人类毛发约有10%的水份,相当影响毛发的机械特性。毛发蛋白质是由双硫键经半胱氨酸连在一起。这个连结非常坚韧,在古埃及墓穴内就曾发现接近完整的毛发。毛发的不同部位亦有不同的半胱氨酸水平,造成较硬或较软的发质。建立或破坏双硫键可以用来控制波浪或卷曲的发型。烫发的基础原理就是破坏及重造双硫键。
二硫键属共价键,某些蛋白质肽链中含有一些半胱氨酸残基, 这种氨基酸残基可形成二硫键, 二硫键可在同一条肽链内或不同肽链之间形成,这种共价键比上述非共价键的强度大,是头发强度的决定因素,其存在的数量对头发的物理化学性能影响很大。烫发过程其实就是二硫键的破坏与重建。
有机化学
编辑京克二硫化物分裂是一个有机反应,将一个二硫化物转变为硫卤化物(R-S-X),当中X是溴(Br)或氯(Cl)。[1]例如将二硫化邻硝基苯(di-o-nitrophenyl disulfide)转为氯化邻硝基苯基硫(o-nitrophenylsulphur chloride)[2],及其他相关反应等。[3][4]
参考
编辑- Sela M and Lifson S. On the Reformation of Disulfide Bridges in Proteins. Biochimica et Biophysica Acta. 1959, 36: 471–478.
- Stark GR. Cleavage at cysteine after cyanylation. Methods in Enzymology. 1977, 11: 238–255.
- Thornton JM. Disulphide Bridges in Globular Proteins. Journal of Molecular Biology. 1981, 151: 261–287.
- Thannhauser TW, Konishi Y and Scheraga HA. Sensitive Quantitative Analysis of Disulfide Bonds in Polypeptides and Proteins. Analytical Biochemistry. 1984, 138: 181–188.
- Wu J and Watson JT. Optimization of the Cleavage Reaction for Cyanylated Cysteinyl Proteins for Eficient and Simplified Mas Mapping. Analytical Biochemistry. 1998, 258: 268–276.
- Futami J, Tada H, Seno M, Ishikami S and Yamada H. Stabilization of Human RNase 1 by Introduction of a Disulfide Bond between Residues 4 and 118. J. Biochem. 2000, 128: 245–250.
- Kadokura H, Katzen F, Beckwith J. Protein disulfide bond formation in prokaryotes. Annu Rev Biochem. 2003, 72: 111–35. PMID 12524212.
- Ellgaard L, Ruddock LW. The human protein disulphide isomerase family: substrate interactions and functional properties. EMBO Rep. Jan 2005, 6 (1): 28–32. PMID 15643448.
注释
编辑- ^ Zincke, Ber. 44, 770 (1911); Zincke and Farr, Ann. 391, 63 (1912)
- ^ Max. H Hubacher. o-Nitrophenylsulphur Chloride (PDF). Organic Syntheses. 1943, 2: 455 [2006-11-28]. (原始内容存档 (PDF)于2009-09-26).
- ^ Daniel S Reno; Richard J Pariza. Phenyl Vinyl Sulfide (PDF). Organic Syntheses. 1998, 9: 662 [2006-11-28]. (原始内容存档 (PDF)于2009-09-26).
- ^ Irwin B Douglass; Richard V Nortan. Methanesulfinyl Chloride (PDF). Organic Syntheses. 1973, 5: 709 [2006-11-28]. (原始内容存档 (PDF)于2009-09-26).
