三氧化氙
化合物
三氧化氙是一種不穩定的化合物,其中氙的化合價為+6。它是很強的氧化劑,會緩慢從水中釋放氧氣,暴露於陽光下會加速反應。它與有機化合物接觸時可能會爆炸。它爆炸時會釋放氙氣和氧氣。
| 三氧化氙 | |
|---|---|
| |

| |
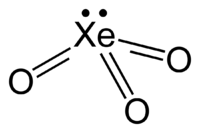
| IUPAC名 三氧化氙 氧化氙(VI) | |
| 識別 | |
| CAS號 | 13776-58-4 |
| ChemSpider | 21106493 |
| SMILES |
|
| InChI |
|
| InChIKey | ZWAWYSBJNBVQHP-UHFFFAOYAR |
| 性質 | |
| 化學式 | XeO3 |
| 摩爾質量 | 179.288 g·mol⁻¹ |
| 外觀 | 白色晶體 |
| 密度 | 4.55 g/cm3 |
| 熔點 | 25 °C(劇烈分解) |
| 溶解性(水) | 可溶(與水反應) |
| 結構 | |
| 分子構型 | 三角錐體 |
| 熱力學 | |
| ΔfHm⦵298K | 402 kJ/mol[1] |
| 危險性 | |
| 歐盟分類 | 未列明 |
| NFPA 704 | |
| 相關物質 | |
| 相關化學品 | 氙酸 四氧化氙 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
化學性質
編輯三氧化氙是一種強氧化劑,可以氧化大多數可以氧化的物質。然而,它的氧化反應緩慢,這降低了它的實用性。[2]
超過 25 °C時,三氧化氙非常容易發生劇烈爆炸:
當三氧化氙溶於水時,會產生酸性的氙酸溶液:
- XeO3(aq) + H2O → H2XeO4 ⇌ H+ + HXeO−
4
該溶液在室溫下穩定,沒有三氧化氙那樣的爆炸性。它可以將羧酸定量地氧化成二氧化碳和水。[3]
三氧化氙溶解在鹼性溶液中會形成氙酸鹽。HXeO−
4 陰離子是氙酸鹽溶液中的主要物種。[4]它們並不穩定,會歧化成高氙酸鹽(氧化態+8)和氙氣。[5] 含有 XeO4−
6 離子的高氙酸鹽可以通過 XeO
3 和氫氧化物溶液反應而成。三氧化氙和KF、RbF和CsF反應,形成通式為 MXeO
3F的化合物。[6]
物理性質
編輯六氟化氙或四氟化氙的水解會產生三氧化氙溶液,通過蒸發可以得到無色的 XeO3 晶體。[7]這些晶體在乾燥空氣中可穩定數天,但容易從潮濕空氣中吸收水分,形成濃溶液。三氧化氙是正交晶系的,晶格參數 a = 6.163 Å、b = 8.115 Å和c = 5.234 Å。它的密度為 4.55 g/cm3。[8]
| XeO3晶體一部分的球棍模型 | 空間填充模型 | 氙原子的幾何配位 |
危險性
編輯參考文獻
編輯- ^ Zumdahl, Steven S. Chemical Principles 6th Ed.. Houghton Mifflin Company. 2009: A23. ISBN 978-0-618-94690-7.
- ^ Greenwood, N.; Earnshaw, A. Chemistry of the Elements. Oxford: Butterworth-Heinemann. 1997.
- ^ Jaselskis B.; Krueger R. H. Titrimetric determination of some organic acids by xenon trioxide oxidation. Talanta. July 1966, 13 (7): 945–949. PMID 18959958. doi:10.1016/0039-9140(66)80192-3.
- ^ Peterson, J. L.; Claassen, H. H.; Appelman, E. H. Vibrational spectra and structures of xenate(VI) and perxenate(VIII) ions in aqueous solution. Inorganic Chemistry. March 1970, 9 (3): 619–621. doi:10.1021/ic50085a037.
- ^ W. Henderson. Main group chemistry . Great Britain: Royal Society of Chemistry. 2000: 152–153. ISBN 0-85404-617-8.
- ^ Egon Wiberg; Nils Wiberg; Arnold Frederick Holleman. Inorganic chemistry. Academic Press. 2001: 399. ISBN 0-12-352651-5.
- ^ John H. Holloway; Eric G. Hope. A. G. Sykes , 編. Recent Advances in Noble-gas Chemistry. Advances in Inorganic Chemistry, Volume 46. Academic Press. 1998: 65. ISBN 0-12-023646-X.
- ^ 8.0 8.1 Templeton, D. H.; Zalkin, A.; Forrester, J. D.; Williamson, S. M. Crystal and Molecular Structure of Xenon Trioxide. Journal of the American Chemical Society. 1963, 85 (6): 817 [2021-11-10]. doi:10.1021/ja00889a037. (原始內容存檔於2021-11-10).
- ^ Bartlett, N.; Rao, P. R. Xenon Hydroxide: an Experimental Hazard. Science. 1963, 139 (3554): 506. Bibcode:1963Sci...139..506B. PMID 17843880. doi:10.1126/science.139.3554.506.
