二磷 編輯
化合物
此條目翻譯品質不佳。 |
二磷是一種無機化合物,化學式P
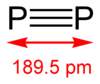
2。磷之上的氮會形成有氮氮三鍵的N2分子,而磷傾向於形成P4,因為P-Pπ鍵的能量很高。二磷的結構類似氮氣,但反應性很高,鍵解離能為(117 kcal/mol或490kJ/mol)氮氣的一半。二磷的鍵長為1.8934 Å。[2]
| 二磷 | |||
|---|---|---|---|
| |||
| IUPAC名 Diphosphorus | |||
| 系統名 Diphosphyne[1] | |||
| 識別 | |||
| CAS號 | 12185-09-0 | ||
| PubChem | 5460700 | ||
| ChemSpider | 4574176 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | FOBPTJZYDGNHLR-UHFFFAOYAU | ||
| Gmelin | 1400241 | ||
| ChEBI | 33472 | ||
| 性質 | |||
| 化學式 | P2 | ||
| 摩爾質量 | 61.95 g·mol−1 | ||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
製備
編輯將白磷加熱至1100 °K(827 °C)可取得二磷。然而,通過一些過渡金屬配合物(例如基於鎢和鈮的配合物),在正常條件下的均相溶液中生成二磷的方面已經取得了一些進展。[3]離解P4分子中的鍵的方法也被提出過,比如光激發。[4]
參考資料
編輯- ^ Diphosphorus (CHEBI:33472). Chemical Entities of Biological Interest (ChEBI). UK: European Bioinformatics Institute. [2021-01-01]. (原始內容存檔於2016-03-04).
- ^ Huber, K. P.; Herzberg, G. Molecular Spectra and Molecular Structure IV. Constants of Diatomic Molecules. New York: Van Nostrand. 1979. ISBN 978-0442233945.
- ^ Piro, Nicholas A.; Figueroa, Joshua S.; McKellar, Jessica T.; Cumnins, Christopher C. Triple-Bond Reactivity of Diphosphorus Molecules. Science. 1 September 2006, 313 (5791): 1276–1279. Bibcode:2006Sci...313.1276P. PMID 16946068. S2CID 27740669. doi:10.1126/science.1129630.
- ^ Lee-Ping Wangb; Daniel Tofana; Jiahao Chena; Troy Van Voorhisa & Christopher C. Cummins. A pathway to diphosphorus from the dissociation of photoexcited tetraphosphorus. RSC Advances (Royal Society of Chemistry). September 2013 [2017-07-21]. (原始內容存檔於2017-07-21). (頁面存檔備份,存於網際網路檔案館)
外部連結
編輯- Ron Dagani, "A Mild Route To P2", Chemical & Engineering News September 4, 2006 Link (頁面存檔備份,存於網際網路檔案館)
- Carmen Drahl "Flash Of Phosphorus Chemistry Innovation", Chemical & Engineering News September 13, 2010 Link