蒸氣壓
此條目可參照外語維基百科相應條目來擴充。 (2017年5月21日) |
此條目沒有列出任何參考或來源。 (2014年7月18日) |
一種物質的蒸氣壓也稱作飽和蒸氣壓,指的是這種物質的氣相與其非氣相達到平衡狀態時的壓強;任何物質(包括液態與固態)都有揮發成為氣態的趨勢,其氣態也同樣具有凝結為液態或者凝華為固態的趨勢。在給定的溫度下,一種物質的氣態與其凝聚態(固態或液態)之間會在某一個壓強下存在動態平衡。此時單位時間內由氣態轉變為凝聚態的分子數與由凝聚態轉變為氣態的分子數相等。這個壓強就是此物質在此溫度下的飽和蒸氣壓。
在密閉空間,物質在給定的溫度下,可使該物質沸騰的氣體分壓,此時蒸發/凝結過程達到動態平衡。當氣體的壓力(分壓)與飽和蒸汽壓相等時,對應的溫度稱為露點,這時空氣的相對濕度為100%。此時如果降低溫度或者增加空氣中水蒸氣的含量,就會出現水凝結的現象。
它們之間的關係可以用克勞修斯-克拉佩龍方程(Clausius–Clapeyron relation)描述[1]。隨着溫度的升高,物質蒸氣壓隨之升高直到足以克服周圍大氣的壓強從而在物質本體內的任何位置發生氣化而產生大量氣泡。這一現象叫做沸騰,而這個溫度叫做此壓強下的沸點。物質的常壓沸點就是此物質的飽和蒸氣壓等於一個標準大氣壓時候的溫度。需要注意的是在較深液體中發生的沸騰所需溫度會高於較淺液體中的沸騰,因為除了大氣壓強外還需要克服液體自身深度所造成的壓強。對於溶液,計算需用拉午耳定律[2]。
水的飽和蒸汽壓可以根據Goff-Gratch方程式確定。
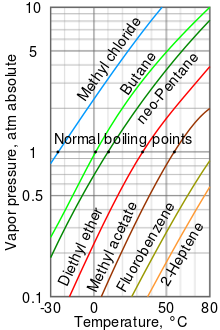
使用安托萬方程計算蒸氣壓
編輯安托萬方程[3][4]是一個用來描述液體或固體的蒸氣壓與溫度的經驗表達式。安托萬方程的原始表達式如下:
將溫度項單獨移至等號左邊後可得:
其中:
- 為該物質的蒸氣壓。
- 為該物質的溫度。
- , 與 為與物質相關的係數 (可為常數或變數),每組 , , 值只適用於特定物質的特定溫度範圍。
而上式在某些情況項又可以被化簡為如下:
總體來說,安托萬方程的使用上有許多限制。例如,該方程無法找出一組可適用於熔點與臨界溫度的範圍內的 , 與 。另外,在建表當時的儀器導致該表於10托下的低壓環境也相當不精準。
參見
編輯參考文獻
編輯- ^ Clausius-Clapeyron Equation. Chemistry LibreTexts. 2014-06-01 [2024-02-16]. (原始內容存檔於2021-04-15) (英語).
- ^ Raoult's Law. Chemistry LibreTexts. 2013-10-02 [2024-02-16]. (原始內容存檔於2024-02-16) (英語).
- ^ Coulson, J. M.; Richardson, J. F.; Sinnott, Raymond K. Chemical engineering. 6: Chemical engineering design. Chemical Engineering Design 4. ed. Amsterdam Heidelberg: Elsevier. 2005: 331. ISBN 978-0-7506-6538-4.
- ^ Antoine's Equation. uweb.engr.arizona.edu. [2024-02-16]. (原始內容存檔於2024-02-16).