三氧化鈾
化合物
三氧化鈾(UO3)是鈾的六價氧化物,可以通過在400℃灼燒硝酸鈾酰得到。它的最常見的晶型是γ-UO3,為橙黃色粉末。
| 三氧化鈾 | |
|---|---|
| |
| IUPAC名 三氧化鈾 氧化鈾(VI) | |
| 別名 | 氧化鈾酰 鈾酸酐 |
| 識別 | |
| CAS號 | 1344-58-7 ? |
| 性質 | |
| 化學式 | UO3 |
| 摩爾質量 | 286.29 g/mol g·mol⁻¹ |
| 外觀 | 橙黃色粉末 |
| 密度 | 5.5–8.7 g/cm3 |
| 熔點 | ~200–650℃(分解) |
| 溶解性(水) | 部分可溶 |
| 結構 | |
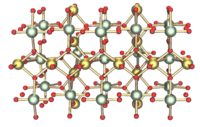
| 晶體結構 | see text |
| 空間群 | I41/amd (γ-UO3) |
| 危險性 | |
| 警示術語 | R:R26/28, R33, R51/53 |
| 安全術語 | S:S1/2, S20/21, S45, S61 |
| MSDS | External MSDS |
| 歐盟編號 | 092-002-00-3 |
| 歐盟分類 | 劇毒(T+) 對環境有害(N) |
| 閃點 | 不可燃 |
| 相關物質 | |
| 相關鈾 氧化物 | 二氧化鈾 八氧化三鈾 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
化學性質
編輯三氧化鈾是一種兩性氧化物,它在溶液中以UO2 2+或U2O7 2-存在。離子方程式:
當UO3表現鹼性時:UO3+2H+ = UO2 2+ H2O
UO3表現酸性時:2UO3+2OH- =U2O7 2- + H20
三氧化鈾可以在400℃和二氟二氯甲烷反應,產生氯氣、光氣、二氧化碳和四氟化鈾;它和三氯氟甲烷反應生成的不是二氧化碳,而是四氯化碳。[1]
- 2 CF2Cl2 + UO3 → UF4 + CO2 + COCl2 + Cl2
- 4 CFCl3 + UO3 → UF4 + 3 COCl2 + CCl4 + Cl2
參考資料
編輯- ^ Booth HS, Krasny-Ergen W, Heath RE. Uranium Tetrafluoride. Journal of the American Chemical Society. 1946, 68 (10): 1969–1970. doi:10.1021/ja01214a028.
- ^ Trofimov TI, Samsonov MD, Lee SC, Myasoedov BF, Wai CM. Dissolution of uranium oxides in supercritical carbon dioxide containing tri-n-butyl phosphate and thenoyltrifluoroacetone. Mendeleev Communications. 2001, 11 (4): 129–130. doi:10.1070/MC2001v011n04ABEH001468.
| 這是一篇關於無機化合物的小作品。您可以透過編輯或修訂擴充其內容。 |