乙基黃原酸鈉
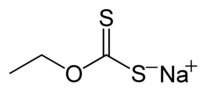
乙基黃原酸鈉(SEX)[3]是一種有機硫化合物,化學式為CH3CH2OCS2Na。它是一種淡黃色粉末,通常以二水合物的形式存在。乙基黃原酸鈉在採礦業中用作浮選劑。[4] 與乙基黃原酸鈉有相同陰離子的對應鉀鹽:乙基黃原酸鉀 (KEX),通常由無水鹽的形式製備得來。
| 乙基黃原酸鈉 | |
|---|---|
| |

| |
| IUPAC名 sodium O-ethylcarbonodithioate | |
| 英文名 | Sodium ethyl xanthate |
| 別名 | O-乙基黃原酸鈉 SEX |
| 識別 | |
| CAS號 | 140-90-9 |
| PubChem | 8824 |
| ChemSpider | 8493 |
| SMILES |
|
| InChI |
|
| InChIKey | RZFBEFUNINJXRQ-UHFFFAOYSA-M |
| EINECS | 205-440-9 |
| 性質 | |
| 化學式 | C3H5NaOS2 |
| 摩爾質量 | 144.19 g·mol−1 |
| 外觀 | 淡黃色粉末[1] |
| 密度 | 1.263 g/cm3[1] |
| 熔點 | 182—256 °C(455—529 K)[1] |
| 沸點 | 分解 |
| 溶解性(水) | 450 g/L (10 °C)[1] |
| pKa | 1.6[1] |
| pKb | 12.4[1] |
| 危險性 | |
| 警示術語 | R:R15 R21 R22 R29 R36 R38 |
| 安全術語 | S:S3 S9 S35 S36 S37 S38 S39 S16 S23 S51 |
| 自燃溫度 | 250 °C(523 K)[2] |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
生產
編輯類似於大多數黃原酸鹽的製備,乙基黃原酸鈉可以通過用二硫化碳和乙醇鈉反應來製備: [5]
性質
編輯乙基黃原酸鈉為淡黃色粉末。如果不加熱,其水溶液在高pH值下是穩定的。它在 25 ℃、pH< 9的水溶液環境中會迅速水解。它的共軛酸pK a理論值為1.6,但游離酸尚屬未知,其pKb估計為12.4 。乙基黃原酸鈉容易吸附在許多硫化礦物的表面。 [2]
在水中分解
編輯黃原酸鹽容易水解和氧化: [6]
- 在水溶液中低pH值水解:
- 被氧氣氧化:
檢測
編輯乙基黃原酸鈉 (SEX) 可以通過紅外線(1179、1160、1115、1085 cm -1 ) 和紫外線 (300 nm) 範圍內的光學吸收峰譜進行識別。此外,有六種以上的化學檢測方法:
- 碘量法依靠碘氧化成雙黃原,用澱粉指示劑檢測產物。然而,這種方法沒有選擇性,並且會受到其他含硫化學品的干擾。 [7]
- 黃原酸鹽可以與硫酸銅或酒石酸銅反應,產生黃原酸銅殘留物,可用碘檢測。該方法的優點是對亞硫酸鹽、硫代硫酸鹽和碳酸鹽雜質不敏感。[8]
- 在酸鹼檢測法中,稀釋的黃原酸鹽水溶液與大量的 0.01 M鹽酸反應,生成二硫化碳和醇,並對其進行測量,之後通過過濾和滴定去除過量的酸和雜質。 [8]
- 在銀量法中,乙基黃原酸鈉在稀溶液中與硝酸銀反應。所得黃原酸銀用10%硝酸鐵水溶液檢測。這種方法的缺點是銀成本高,且硝酸銀會使黃原酸銀變黑,從而降低檢測精度。[8]
- 測汞法是將黃原酸鹽溶於40%二甲胺水溶液,加熱滴定,用鄰羥基汞苯甲酸滴定,滴定產物用硫代熒光素檢測。[8]
- 高氯酸法涉及將黃原酸鹽溶解在無水醋酸中。產品用高氯酸滴定,並以結晶紫檢測。[8]
乙基黃原酸鈉也可以使用重量法定量,通過稱量 乙基黃原酸鈉 與 10% 硝酸鉛溶液反應後得到的黃原酸鉛殘留物。還有幾種電化學檢測方法,可以與上述一些化學技術結合使用。 [8]
應用
編輯乙基黃原酸鈉是在採礦業作為金屬如銅、鎳、銀或金的浮選劑,以及從礦石中固體金屬硫化物或氧化物的回收漿料。該應用方式由 Cornelius H. Keller 於 1925 年提出。乙基黃原酸鈉的其他應用包括做為落葉劑、除草劑和橡膠添加劑,以保護橡膠免受氧氣和臭氧的影響。 [9]
西元2000 年時,澳大利亞生產了多達 10,000噸乙基黃原酸鈉,進口了約 6,000 噸,其中大部分來自中國。 [10]在澳大利亞生產的乙基黃原酸鈉為40%的固體水溶液,被稱為「液體乙基黃原酸鈉」。 [11]它是通過用氫氧化鈉和乙醇在密閉空間中和二硫化碳共同反應獲得的。 [12]其密度為1.2 g/cm 3 ,凝固點為-6 °C。 [13]
安全
編輯乙基黃原酸鈉對動物有中等經口服和皮膚接觸毒性,且對眼睛和皮膚有刺激性。 [12]它對水生生物尤其有毒,因此其處置受到嚴格控制。 [14] (雄性白化病小鼠,口服,pH~11 的 10% 溶液)的中位致死劑量為 730 毫克/千克體重,大多數死亡個例發生在第一天,且發現受乙基黃原酸鈉毒性影響最嚴重的器官是中樞神經系統、肝臟和脾臟。 [15]
自 西元1993 年以來,乙基黃原酸鈉在澳大利亞被列為優先評估既有化學物質,這意味着其製造、處理、儲存、使用或處置可能會對健康或環境產生不利影響。由於該化學品在工業中的廣泛使用及其分解為有毒和易燃的二硫化碳氣體,該決定被廣泛視為是合理的。在澳大利亞發生的兩個乙基黃原酸鈉泄漏案例中,一個導致 100 人疏散,6 名接觸煙霧的工人住院治療。在另一起事故中,泄漏區域的居民回報頭痛、頭暈和噁心的症狀。 [16]因此,在高風險乙基黃原酸鈉處理操作中,澳大利亞法規要求工人配備防護服、防靜電手套、靴子和全面罩呼吸器或自給式呼吸器。 [17]
相關條目
編輯參考資料
編輯- ^ 1.0 1.1 1.2 1.3 1.4 1.5 Report 5 (1995) p. 5
- ^ 2.0 2.1 Report 5 (1995) p. 6
- ^ Caroline Cooper. Organic Chemist's Desk Reference. CRC Press. 23 July 2010: 123 (Acronyms and Miscellaneous Terms used in Describing Organic Molecules) [22 February 2011]. ISBN 978-1-4398-1164-1. (原始內容存檔於2021-07-12).
- ^ Kathrin-Maria Roy. Xanthates. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. 2005. ISBN 3527306730. doi:10.1002/14356007.a28_423.
- ^ Ingram, G.; Toms, B. A. The reactions of sodium ethyl xanthate with ethanol and with water.. Journal of the Chemical Society (Resumed). 1961: 117–127. doi:10.1039/JR9610000117.
- ^ Report 5 (1995) pp. 14–16
- ^ Report 5 (1995) p. 8
- ^ 8.0 8.1 8.2 8.3 8.4 8.5 Report 5 (1995) p. 9
- ^ Report 5 (1995), p. 2, citing Rao, R.S., 「Xanthates and Related Compounds」, Marcel Dekker, New York, 1971 ISBN 0-8247-1563-2 and Keller, C.H. (1925) 美國專利第1,554,216號 "Concentration of gold, sulphide minerals and uranium oxide minerals by flotation from ores and metallurgical plant products"
- ^ Report 5s (2000) p. 1
- ^ Report 5s (2000) p. 3
- ^ 12.0 12.1 Report 5s (2000) p. v
- ^ Report 5s (2000) p. 7
- ^ Report 5 (1995) pp. 43–45
- ^ Report 5 (1995) p. 17
- ^ Report 5 (1995) p. 1
- ^ Report 5s (2000) p. vi
參考書目
編輯- Priority existing chemical Report No. 5 Sodium Ethyl Xanthate, National Industrial Chemicals Notification and Assessment Scheme, Dep. of Health and Ageing, Australian Government (1995) ISBN 0-644-35283-3
- Priority Existing Chemical. Secondary Notification Assessment Report No. 5S Sodium Ethyl Xanthate, National Industrial Chemicals Notification and Assessment Scheme, Dep. of Health and Ageing, Australian Government, (February 2000) ISBN 0-642-42198-6