乙酸鈣
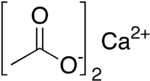
乙酸鈣是鈣的乙酸鹽,分子式為Ca(C2H3O2)2。乙酸鈣的常用名是醋酸鈣。無水乙酸鈣的吸濕性非常好,因此常見的乙酸鈣都以一水合(Ca(CH3COO)2.H2O,CAS [5743-26-0])的形式存在。
| 乙酸鈣 | |
|---|---|
| |
| IUPAC名 Calcium acetate 乙酸鈣 | |
| 英文名 | Calcium acetate |
| 別名 | 醋酸鈣 |
| 識別 | |
| 縮寫 | Ca(OAc)2 |
| CAS號 | 62-54-4 5743-26-0(monohydrate) |
| PubChem | 6116 |
| ChemSpider | 5890 |
| SMILES |
|
| InChI |
|
| InChIKey | VSGNNIFQASZAOI-NUQVWONBAW |
| EINECS | 269-613-0 |
| ChEBI | 3310 |
| RTECS | AF7525000 |
| DrugBank | DB00258 |
| 性質 | |
| 化學式 | C4H6O4Ca |
| 摩爾質量 | 158.138 g·mol⁻¹ |
| 外觀 | 白色固體 |
| 氣味 | 略帶乙酸氣味 |
| 密度 | 1.6 kg/L |
| 熔點 | 160 °C(分解生成丙酮) |
| 溶解性(水) | 400 g/l |
| 危險性 | |
| NFPA 704 | |
| 自燃溫度 | 680 - 730 °C |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
如果在飽和乙酸鈣溶液中加入醇的話,會生成一種半固態、可燃的膠體,很某些像罐裝燃料產品,例如Sterno。[1] 「加利福尼亞雪球」其實就是將乙酸鈣和乙醇混合。產生的膠體顏色是白色的,堆起來就像雪球一樣。
醋酸氯鈣石是五水合氯化乙酸鈣,它被認為是一種礦物質但往往是因為人類活動而產生的。
歷史
編輯用途
編輯在腎臟疾病中,血液中磷酸濃度可能升高(高磷酸鹽血)並導致一些關於骨的問題。在日常飲食中可以攝入醋酸鈣來與多餘的磷酸結合。此方法的副作用是肚子疼。
醋酸鈣也是一種食品添加劑,主要用在糖果產品中。
生產
編輯CaCO3(s) + 2CH3COOH(aq) → Ca(CH3COO)2(aq) + H2O(l) + CO2(g)
Ca(OH)2(s) + 2CH3COOH(aq) → Ca(CH3COO)2(aq) + 2H2O(l)
參考資料
編輯- ^ "Canned Heat" at Journal of Chemical Education "Chemistry comes alive!". [2008-10-11]. (原始內容存檔於2008-10-03).
- ^ Leo Frank Goodwin and Edward Tyghe Sterne. Losses Incurred in the Preparation of Acetone by the Distillation of Acetate of Lime.. Industrial & Engineering Chemistry. 1920, 12 (3): 240–243. doi:10.1021/ie50123a012.
- ^ E. G. R. Ardagh, A. D. Bbarbour, G. E. McClellan, and E. W. McBride. Distillation of Acetate of Lime.. Industrial & Engineering Chemistry. 1924, 16 (11): 1133–1139. doi:10.1021/ie50179a013.
