六硼化鈣
六硼化鈣(又稱硼化鈣),是鈣和硼的化合物,化學式為CaB6。具有優良導電性、高硬度、化學穩定性和高熔點,是重要的材料。是一種黑色、有光澤、不活潑的粉末,密度小。具有典型的金屬硼化物的立方結構,由6個硼原子的八面體單元與鈣原子結合。[2] CaB6和摻雜鑭的CaB6都表現出弱鐵磁性,這是一個值得注意的事實,因為鈣和硼既不是磁性的,也不具有內部3d或4f電子殼層,這通常是鐵磁性所必需的。
| 六硼化鈣 | |
|---|---|
| |
| IUPAC名 Calcium hexaboride | |
| 別名 | 硼化鈣 |
| 識別 | |
| CAS號 | 12007-99-7 |
| PubChem | 16212529 |
| ChemSpider | 24765176 |
| SMILES |
|
| InChI |
|
| EINECS | 234-525-3 |
| 性質 | |
| 化學式 | CaB6 |
| 摩爾質量 | 104.94 g·mol⁻¹ |
| 外觀 | 黑色粉末 |
| 密度 | 2.45 g/cm3 |
| 熔點 | 2235 °C(2508 K) |
| 溶解性(水) | 不可溶 |
| 結構 | |
| 晶體結構 | 立方晶系 |
| 空間群 | Pm3m ; Oh[1] |
| 相關物質 | |
| 相關化學品 | 四硼化鈣 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
屬性
編輯CaB6曾由於具有各種特殊的物理性質,例如超導性、價態波動和近藤效應而被研究。[3] 然而,CaB6最顯着的特性是其鐵磁性。 它意外出現在高溫(600 K)和低磁矩(低於0.07 每個原子)下。這種高溫鐵磁性的來源是稀釋電子氣的鐵磁相與硼化鈣中假定的激子態或樣品表面上的外部雜質的連接。雜質可能包括鐵和鎳 ,可能來自用於製備樣品的硼中。[4]
CaB6不溶於水、甲醇和乙醇,並且在酸中緩慢溶解。[5] 顯微硬度是27GPa, 努氏硬度為2600kg / mm2 ,楊氏模量為379 GPa,純晶體電阻率大於2·10 10Ω·m。 [6] [7] CaB6是能隙約為1.0電子伏特的半導體。許多CaB6樣品的低、半金屬電導率可以解釋為由於雜質和可能的非化學計量目的的無意摻雜導致。[8]
結構信息
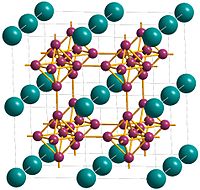
編輯六硼化鈣的晶體結構是立方晶格,晶胞中心是鈣,頂點是通過硼硼鍵連接的緊密規則的硼原子八面體形成的三維硼網絡。[5]每個鈣都有24個最近鄰的硼原子。[1]鈣原子以簡單的立方體堆積排列,因此在位於立方體頂點的八個鈣原子之間存在空穴。[9] 通過引入八面體B6基團來擴展簡單的立方結構,該結構由鈣和六硼化物基團填充,類似於CsCl。[9] 描述六硼化鈣的另一種方式是具有金屬B6 2-八面體聚合陰離子的CsCl型結構,鈣原子佔據Cs位點,B6八面體在Cl位點。 [10] Ca-B鍵長為3.05Å,BB鍵長度為1.7Å。[9]
43Ca的核磁共振NMR數據包含-56.0 ppm的δ峰和在-41.3 ppm的δ異,其中δ異最大峰寬度取為0.85,負偏移是由於高配位數。 [10]
拉曼數據:由於活動模式分別為A1g,Eg和T2g,硼化鈣在754.3、1121.8和1246.9cm-1處有三個拉曼峰。 [1]
觀察到的振動頻率cm-1:1270(強)來自A1g伸展,1154(中位)和1125(肩部)來自Eg伸展,526、520、485和470來自F1g旋轉,775(強)和762(肩部)來自F2g彎曲,1125(強)和1095(弱)來自F1u彎曲,330和250來自F1u平移,以及880(中間)和779來自F2u彎曲。 [1]
製備
編輯- 工業生產的主要反應之一是: [6]
- CaO + 3 B2O3 + 10 Mg → CaB6 + 10 MgO
其他生產CaB6粉末的方法包括:
- 鈣或氧化鈣和硼在1000℃下直接反應;
- Ca + 6B→CaB6
- Ca(OH) 2 + 7B→CaB6 + BO(g) + H2O(g)
- CaCl2 + 6NaBH4 →CaB6 + 2NaCl + 12H2 + 4Na
生產出的材料質量相對較差。 [12]
用途
編輯硼化鈣用於製造硼合金鋼[5]和作為去氧試劑無氧銅的生產。後者由於硼在銅中的低溶解度導致比常規磷去氧銅更高的導電性。[6]CaB6還可用作高溫材料、表面保護、磨料、工具和耐磨材料。
CaB6導電性優良,功函數低,因此可用作熱陰極材料。在高溫下使用時,硼化鈣會被氧化,導致其性能降低並縮短其使用壽命。[13]
CaB6也是n型熱電材料的有希望的候選者,因為其功率因數不小於普通熱電材料Bi2Te3和PbTe的功率因數。 [7]
CaB6也可用作碳粘結耐火材料中的抗氧化劑。
注意事項
編輯硼化鈣對眼睛、皮膚和呼吸系統有刺激性。本產品處理時應使用適當的防護眼鏡和防護服。切勿將硼化鈣倒入排水管或向其中加水。
參見
編輯參考文獻
編輯- ^ 1.0 1.1 1.2 1.3 Yahia, S.; Turrell, S.; Turrell, G.; Mercurio, J. P. Infrared and Raman spectra of hexaborides: force-field calculations, and isotopic effects. J. Mol. Struct. 1990, 224 (1-2): 303–312. Bibcode:1990JMoSt.224..303Y. doi:10.1016/0022-2860(90)87025-S.
- ^ Matkovich, V. I. Boron and Refractory Borides. Berlin: Springer-Verlag. 1977. ISBN 0-387-08181-X.
- ^ J. Etourneau; P. Hagenmuller. Structure and physical features of the rare-earth borides. Philos. Mag. B. 1985, 52 (3): 589. Bibcode:1985PMagB..52..589E. doi:10.1080/13642818508240625..
- ^ Young, D. P; et al. High-temperature weak ferromagnetism in a low-density free-electron gas. Nature. 1999, 397 (6718): 412–414. Bibcode:1999Natur.397..412Y. doi:10.1038/17081.
- ^ 5.0 5.1 5.2 5.3 Calcium boride – Dictionary of Inorganic Compounds. University Press 1 (Cambridge). 1992.
- ^ 6.0 6.1 6.2 Encyclopedia of Inorganic Chemistry 1. West Sussex, England: John Wiley & Sons. 1994.
- ^ 7.0 7.1 7.2 Terry T. Xu; Jian-Guo Zheng; Alan W. Nicholls; Sasha Stankovich; Richard D. Piner; Rodney S. Ruoff. Single-Crystal Calcium Hexaboride Nanowires: Synthesis and Characterization. Nano Lett. 2004, 4 (10): 2051–2055. Bibcode:2004NanoL...4.2051X. doi:10.1021/nl0486620.
- ^ S. Souma; et al. Electronic Band Structure and Fermi Surface of CaB6 Studied by Angle-Resolved Photoemission Spectroscopy. Phys. Rev. Lett. 2003, 90 (2): 027202. Bibcode:2003PhRvL..90b7202S. PMID 12570575. doi:10.1103/PhysRevLett.90.027202.
- ^ 9.0 9.1 9.2 Wells, A. F. Structural Inorganic Chemistry. Oxford: Clarendon Press. 1984: 1055–1056. ISBN 0-19-855125-8.
- ^ 10.0 10.1 Zhongijie, L.; Smith, M. E.; Sowrey, F. E.; Newport, R. J. Probing the local structural environment of calcium by natural-abundance solid-state 43Ca NMR. Physical Review B. 2004, 69 (22): 224107. Bibcode:2004PhRvB..69v4107L. doi:10.1103/PhysRevB.69.224107.
- ^ 11.0 11.1 S. Otani. Preparation of CaB6 crystals by the floating zone method. Journal of Crystal Growth. 1998, 192 (1–2): 346–349. Bibcode:1998JCrGr.192..346O. doi:10.1016/S0022-0248(98)00444-8.
- ^ Shi, L.; et al. Low Temperature Synthesis and Characterization of Cubic CaB6 Ultrafine Powders. Chem. Lett. 2003, 32 (10): 958. doi:10.1246/cl.2003.958.
- ^ Zhigang R. Li; Hong Meng. Organic light-emitting materials and devices. CRC Press. 2006: 516. ISBN 1-57444-574-X.
拓展閱讀
編輯- Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4. Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4. Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.