勞森試劑
化合物
勞森試劑(Lawesson試劑、LR),也稱勞氏試劑,是常用於製取有機硫化合物的一個化學試劑。它是微黃色的固體粉末,具有強烈難聞的腐爛氣味。1956年首先由芳烴與十硫化四磷反應製得。[1]瑞典化學家Sven-Olov Lawesson仔細研究了其與有機化合物的反應,使其應用大大推廣,因此名稱也由此得來。[2]
| 勞森試劑 | |
|---|---|
| |

| |
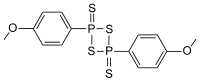
| IUPAC名 2,4-bis(4-methoxyphenyl)- 1,3,2,4-dithiadiphosphetane 2,4-disulfide | |
| 別名 | Lawesson試劑、LR、 勞氏試劑 |
| 識別 | |
| CAS號 | 19172-47-5 |
| SMILES |
|
| 性質 | |
| 化學式 | C14H14O2P2S4 |
| 摩爾質量 | 404.47 g·mol⁻¹ |
| 外觀 | 微黃色粉末 |
| 熔點 | 228 - 231 °C |
| 溶解性(水) | 不可溶 |
| 危險性 | |
| 警示術語 | R:R15/29, R20/21/22 |
| 安全術語 | S:S22, S45, S7/8 |
| 歐盟分類 | 刺激物 有害 (XN) |
| 相關物質 | |
| 相關硫化試劑 | 硫化氫、十硫化四磷 |
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |
勞森試劑是一個氧硫交換試劑,最常見的應用是硫代酰胺的製取。
製備
編輯將十硫化四磷(五硫化二磷)與苯甲醚混合,加熱回流反應。至反應液澄清,不再有硫化氫產生時,[3]冷卻,將晶體過濾並在甲苯或二甲苯中重結晶,便得到勞森試劑。
該試劑具有強烈難聞的氣味。製備反應應當於通風櫥中進行。反應後的器具用次氯酸鈉洗滌。
機理
編輯勞森試劑的分子含有硫和磷交替組成的四元環結構。加熱時發生解聚,生成兩個不穩定的硫代磷葉立德(R-PS2),它們是主要的反應活性中間體。用兩個取代基不同的勞森試劑反應時,在產物的31P NMR譜中觀測到了取代基發生互換的分子,因此證實了中間體R-PS2的存在。
應用
編輯勞森試劑是一個氧硫交換試劑,其最常用的用途是將羰基化合物轉化為硫酮化合物,可以反應的底物包括酮[4]、酯[5]、內酯[6]、酰胺、內酰胺[7]、醌等。富電子的羰基更容易反應。與α,β-不飽和醛酮反應時,雙鍵不受影響。
其他:
- 脂肪族、芳香族和雜環芳香一級酰胺都可較好地與勞森試劑反應。十硫化四磷也是常用的硫化試劑,但它的使用有時會使酰胺分解產生腈和硫化氫,從而使反應產率降低;
- 高氯酸銀與勞森試劑的混合物可以用作親氧的路易斯酸,催化二烯烴與α,β-不飽和醛的狄爾斯-阿爾德反應;
- 1,4-二酮與勞森試劑反應環化為噻吩。用十硫化四磷也可以反應,但反應需要的溫度更高;
- 勞森試劑與亞碸反應生成硫代產物,然後脫硫生成硫醚。因此可作亞碸的還原劑;
- 勞森試劑與苯環上鄰位連有羥基或氨基的酰胺反應產率不高,原因是生成了如下的副產物。該反應可用於硫代單烷基膦酸酯類化合物的製取:
相關試劑
編輯很多類似於勞森試劑的化合物都已經製得,它們比勞森試劑更容易使用,反應條件溫和,產率也比較高。甲氧基苯基被烷基(如甲基、乙基、異丙基、丁基)硫基取代後,形成的試劑稱為Davy試劑(DR),[13]取代基為苯基硫基時稱為Japanese試劑(JR),[14]為對苯氧基苯基時稱為Belleau試劑(BR)。[15]它們都可由相應的硫醇與十硫化四磷製備。
參考資料
編輯- ^ Lecher, H. Z.; Greenwood, R. A.; Whitehouse, K. C.; Chao, T. H. The Phosphonation of Aromatic Compounds with Phosphorus Pentasulfide. J. Am. Chem. Soc. 1956, 78: 5018. doi:10.1021/ja01600a058.
- ^ Pedersen B. S., Scheibye S., Nilson N, H,, Lawesson S. O. Studies on Organophosphorus Compounds .10. Synthesis of Thioketones. Bulletin des Societes Chimiques Belges. 1978, 87 (3): 223–228.
- ^ Thomsen, I.; Clausen, K.; Scheibye, S.; Lawesson, S.-O. (1990). "Thiation with 2,4-Bis(4-methoxyphenyl)-1,3,2,4-Dithiadiphosphetane 2,4-disulfide: N-Methylthiopyrrolidone". Org. Synth.; Coll. Vol. 7: 372.
- ^ Pedersen, B. S.; Scheibye, S.; Nilsson, N. H.; Lawesson, S.-O. Bull. Soc. Chim. Belg. 1978, (87): 223. 缺少或
|title=為空 (幫助) - ^ Jones, B. A.; Bradshaw, J. S. Synthesis and reduction of thiocarboxylic O-esters. Chem. Rev. (Review). 1984, 84 (84): 17. doi:10.1021/cr00059a002.
- ^ Scheibye, S.; Kristensen, J.; Lawesson, S.-O. Studies on organophosphorus compounds—XXVII Synthesis of thiono-, thiolo- and dithiolactones. Tetrahedron. 1979, 35 (35): 1339. doi:10.1016/0040-4020(79)85027-9.
- ^ Shabana, R.; Scheibye, S.; Clausen, K.; Olesen, S. O.; Lawesson, S.-O. Nouv. J. Chim. 1980, (4): 47. 缺少或
|title=為空 (幫助) - ^ Cherkasov, R. A.; Kutyrev, G. A.; Pudovik, A. N. Tetrahedron report number 186 Organothiophosphorus reagents in organic synthesis. Tetrahedron (Review). 1985, 41 (41): 2567. doi:10.1016/S0040-4020(01)96363-X.
- ^ Foreman, M.S.; Woollins, J.D. Organo-P-S and P-Se heterocycles. J. Chem. Soc., Dalton Trans. 2000: 1533–1543. doi:10.1039/b000620n.
- ^ Martin Jesberger, Thomas P. Davis, Leonie Barner. Applications of Lawesson’s Reagent in Organic and Organometallic Syntheses. Synthesis (Review). 2003, 2003: 1929–1958. doi:10.1055/s-2003-41447.
- ^ Cava, M. P.; Levinson, M. I. Thionation reactions of Lawesson's reagents. Tetrahedron. 1985, 41 (22): 5061–5087. doi:10.1016/S0040-4020(01)96753-5.
- ^ Daniel Brayton, Faith E. Jacobsen, Seth M. Cohen and Patrick J. Farmer. A novel heterocyclic atom exchange reaction with Lawesson's reagent: a one-pot synthesis of dithiomaltol. Chemical Communications. 2006, 2006: 206–208. doi:10.1039/b511966a.
- ^ Davy, H. Sulfur Lett. 1985, 3, 39.
- ^ Yokoyama, M.; Hasegawa, Y.; Hatanaka, H.; Kawazoe, Y.; Imamoto, T. Synthesis 1984, 827–828. DOI: 10.1055/s-1984-30980
- ^ Lajoie, G.; Lépine, F.; Maziak, L.; Belleau, B. Tetrahedron Lett. 1983, 24, 3815–3818. DOI: 10.1016/S0040-4039(00)94282-5
外部連結
編輯- 「勞森試劑」於organic-chemistry.org (頁面存檔備份,存於互聯網檔案館)