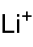氨基鋰
化合物
氨基鋰是一種無機化合物,化學式為Li+NH2-。它由鋰離子和氨基陰離子(氨的共軛鹼)構成。它與氫化鋰、亞氨基鋰都是具有良好前景的儲氫材料。
| 氨基鋰 | |||
|---|---|---|---|
| |||
| IUPAC名 Lithium amide | |||
| 別名 | 氨基化鋰 | ||
| 識別 | |||
| CAS編號 | 7782-89-0 | ||
| PubChem | 16211536 | ||
| ChemSpider | 22939 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | AFRJJFRNGGLMDW-UHFFFAOYAO | ||
| 性質 | |||
| 化學式 | LiNH2 | ||
| 摩爾質量 | 22.96 g·mol⁻¹ | ||
| 外觀 | 白色固體 | ||
| 密度 | 1.178 g/cm3 | ||
| 熔點 | 390 °C | ||
| 沸點 | 430 °C | ||
| 溶解性(水) | 分解 | ||
| 危險性 | |||
| NFPA 704 | |||
| 若非註明,所有數據均出自標準狀態(25 ℃,100 kPa)下。 | |||
性質
編輯其他胺的鋰鹽可以用類似方法製備,也就是用相應的胺代替液氨:
工業上可由氫化鋰與氨氣反應製得,也可將金屬鋰直接在400℃下與氨氣反應:
熔融的氨基鋰呈綠色,冷卻後恢復白色。在空氣中氨基鋰緩慢分解,對其加強熱則猛烈分解,但不會爆炸。加熱到450℃時,分解為亞氨基鋰和氨氣[1]。
氨基鋰難溶於液氨,可溶於冷水,溶於熱水迅速水解成氫氧化鋰和氨氣。 氨基鋰是很活潑的化合物,具有強鹼性。它們都是親核性鹼,除非氮原子由於空間位阻而無法進攻碳原子(例如LDA)。
結構
編輯氨基鋰是一種白色固體,晶體結構屬四方晶系,晶格常數a=501.6pm,c=1022pm,每個晶胞中含8個LiNH2[1]。
其他氨基鋰
編輯由胺的共軛鹼形成的化合物稱為氨基化物。因此氨基鋰可能也指胺的鋰鹽,例如Li+NR2-。一個常見的例子是二異丙基氨基鋰(簡稱LDA),它在有機合成中是常用的強鹼。
例子
編輯2,2,6,6-四甲基哌啶鋰
編輯2,2,6,6-四甲基哌啶鋰晶體是四聚體:
三聚體雙(1-苯基乙基)氨基鋰
編輯此外,雙(1-苯基乙基)氨基鋰晶體是三聚體:
製備醇鹽和金屬氨基化物的混合低聚體也是有可能的。[4]它們與醇鹽和烷基鋰配製成的超強鹼類似。當氮原子與一個鋰原子形成σ鍵並通過孤對電子與另一個金屬原子形成配位鍵時,可以形成環狀的低聚體。
參見
編輯參考資料
編輯- ^ 1.0 1.1 張青蓮. 《无机化学丛书》第一卷:稀有气体、氢、碱金属. 北京: 科學出版社. : P337. ISBN 7-03-002238-6.
- ^ M.F. Lappert, M.J. Slade, A. Singh, J.L. Atwood, R.D. Rogers and R. Shakir. Structure and reactivity of sterically hindered lithium amides and their diethyl etherates: crystal and molecular structures of [Li{N(SiMe3)2}(OEt2)]2 and tetrakis(2,2,6,6-tetramethylpiperidinatolithium). Journal of the American Chemical Society. 1983, 105 (2): 302–304. doi:10.1021/ja00340a031.
- ^ D.R. Armstrong, K.W. Henderson, A.R. Kennedy, W.J. Kerr, F.S. Mair, J.H. Moir, P.H. Moran and R. Snaith, Dalton Transactions, 1999, 4063.
- ^ K.W. Henderson, D.S. Walther and P.G. Williard. Identification of a Unimetal Complex of Bases by 6Li NMR Spectroscopy and Single-Crystal Analysis. Journal of the American Chemical Society. 1995, 117 (33): 8680–8681. doi:10.1021/ja00138a030.
- Merck Index, 11th Edition, 5398.