焦耳-湯姆孫效應
焦耳-湯姆生效應是指氣體會因在等焓的環境氮氣的膨脹,而使溫度上升或下降。這個過程稱為焦耳-湯姆生過程。
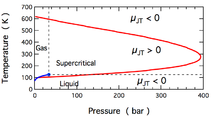
描述
編輯各種氣體定律說明了溫度、壓力和體積。當體積不可逆回地上升,這些定律不能清楚說明壓力和溫度的改變。而在可逆絕熱過程中,氣體膨脹做了正功,因此溫度下降。
可是,真實氣體(相對理想氣體而言)在等焓環境下自由膨脹,溫度會上升或下降(是哪方看初始溫度而定)。對於給定壓力,真實氣體有一個焦耳-湯姆生反轉溫度,高於溫度時氣體溫度會上升,低於時氣體溫度下降,剛好在這溫度時氣體溫度不變。許多氣體的在1大氣壓力下的反轉溫度高於室溫。
焦耳-湯姆生系數
編輯在焦耳-湯姆生過程,溫度隨壓力的改變稱為焦耳-湯姆生系數:
對於不同氣體,在不同壓力和溫度下, 的值不同。 可正可負。考慮氣體膨脹,此時壓力必下降,故 。
| 是 | 因為 是 | 因此 必是 | 氣體 |
|---|---|---|---|
| + | - | - | 冷卻 |
| - | - | + | 變暖 |
若 ,則溫度不隨壓力也不隨體積而變,此時氣體位於反轉點,而此溫度稱之反轉溫度。
氦和氫在1個大氣壓力下,反轉溫度相當低(例如氦便是−222℃)。因此,這兩種氣體在室溫膨脹時溫度上升。
對於理想氣體, 。
原理
編輯溫度下降:當氣體膨脹,分子之間的平均距離上升。因為分子間吸引力,氣體的位能上升。因為這是等焓過程,系統的總能量守恆,所以位能上升必然會令動能下降,故此溫度下降。
溫度上升:當分子碰撞,動能暫時轉成位能。由於分子之間的平均距離上升,每段時間的平均碰撞次數下降,位能下降,因此動能上升,溫度上升。
低於反轉溫度時,前者的影響較為明顯,高於反轉溫度時,後者影響較明顯。
應用
編輯焦耳第二定律
編輯很容易證實,對於由合適的微觀假設定義的理想氣體,αT = 1,因此在焦耳-湯姆遜膨脹下這種理想氣體的溫度變化為零。對於這樣一種理想的氣體,這個理論結果意味着:
- 理想氣體的固定質量的內部能量僅取決於其溫度(而非壓力或體積)。
參考資料
編輯- ^ Partington, J.R. (1949). An Advanced Treatise on Physical Chemistry, volume 1 Fundamental Principles. The Properties of Gases, Longmans, Green and Co., London, pp. 614–615.
- ^ Adkins, C.J. (1968/1983). Equilibrium Thermodynamics, (1st edition 1968), third edition 1983, Cambridge University Press, Cambridge UK, ISBN 0-521-25445-0, p. 116.
- ^ Bailyn, M. (1994). A Survey of Thermodynamics, American Institute of Physics Press, New York, ISBN 0-88318-797-3, p. 81.
參考文獻
編輯- Zemansky, M.W. Heat and Thermodynamics. McGraw-Hill. 1968., p.182, 335
- Schroeder, Daniel V. Thermal Physics. Addison Wesley Longman. 2000., p.142
- Kittel, C., and Kroemer, H. Thermal Physics. W.H. Freeman and Co. 1980.
- Perry, R.H. and Green, D.W. Perry's Chemical Engineers' Handbook. McGraw-Hill Book Co. 1984. ISBN 978-0-07-049479-4.