羊毛硫氨酸
羊毛硫氨酸(英语:Lanthionine,缩写LAN)是一种非蛋白质氨基酸,化学式为 C6H12N2O4S。其在生物体内常由半胱氨酸残基与脱水丝氨酸残基结合得到。
| 羊毛硫氨酸 | |
|---|---|
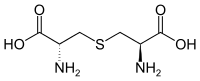
| |
| IUPAC名 S-[(2R)-2-Amino-2-carboxyethyl]-L-cysteine | |
| 识别 | |
| CAS号 | 922-55-4 |
| PubChem | 256406 |
| ChemSpider | 88959 |
| SMILES |
|
| InChI |
|
| InChIKey | DWPCPZJAHOETAG-IMJSIDKUBX |
| ChEBI | 21347 |
| 性质 | |
| 化学式 | C6H12N2O4S |
| 摩尔质量 | 208.2318 g·mol⁻¹ |
| 熔点 | 280 - 283 °C(270 K) |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
历史
编辑羊毛硫氨酸于1941年首次从碳酸钠处理过的羊毛中分离得到,并发现其为一种含硫氨基酸,于是根据羊毛拉丁语“Lana”和硫希腊语“theîon”命名为“lanthionine”[1]。羊毛硫氨酸的首次人工制备是利用3-氯丙氨酸与半胱氨酸发生烷基化反应实现[2]。
分布
编辑羊毛硫氨酸在自然界中广泛存在,人们已在毛发、乳白蛋白以及羽毛中得到了羊毛硫氨酸。在细菌细胞壁以及一些微生物基因编码产生的肽类抗生素中也发现了羊毛硫氨酸。这类抗生素被称为羊毛硫抗生素(lantibiotics),如食品防腐剂乳酸链球菌素[3]、枯草菌素、表皮素(用于杀灭葡萄球菌和链球菌)、阿肽加定、以及血管紧张肽转化酶抑制肽(ancovenin)等[4][5]。
制备
编辑现已报道了多种羊毛硫氨酸合成方法,如丝氨酸硫化法[6]、丝氨酸β-内酯开环法[5]、脱氢丙氨酸与丝氨酸杂共轭加成法等[7]。然而在羊毛硫抗生素的全合成中,只采纳了第一种方法。
生物合成含有羊毛硫氨酸桥接的肽类产物有多种途径,例如,乳酸链球菌合成乳酸链球菌素中的羊毛硫氨酸的过程中,用到了专门的脱水酶 (NisB) 和环化酶 (NisC)[8][9]。
参考文献
编辑- ^ Horn, M. J.; Jones, D. B.; Ringel, S. J. (1941) Isolation of a New Sulfur-Containing Amino Acid (Lanthionine) from Sodium Carbonate-Treated Wool. Journal of Biological Chemistry, 138, 141-149.
- ^ Brown, G. B.; du Vigneaud, V. (1941) The Stereoisomeric Forms of Lanthionine. Journal of Biological Chemistry, 140, 767-771.
- ^ 中国食品添加剂生产应用工业协会 (编). (十六) 乳酸链球菌素 Nisin. 食品添加剂手册. 北京: 中国轻工业出版社. 1996.
- ^ Paul, M.; van der Donk, W. A. (2005) Chemical and Enzymatic Synthesis of Lanthionines. Mini-Reviews in Organic Chemistry, 2, 23-37.
- ^ 5.0 5.1 Shao, H.; Wang, S. H. H.; Lee, C.-W.; Ösapay, G.; Goodman, M. (1995) A Facile Synthesis of Orthogonally Protected Stereoisomeric Lanthionines by Regioselective Ring Opening of Serine β-Lactone Derivatives. Journal of Organic Chemistry, 60, 2956-2957.
- ^ Harpp, D. N.; Gleason, J. G. (1971) Preparation and Mass Spectral Properties of Cystine and Lanthionine Derivatives. Novel Synthesis of L-Lanthionine by Selective Desulfurization. Journal of Organic Chemistry, 36, 73-80.
- ^ Probert, J. M.; Rennex, D.; Bradley, M. (1996) Lanthionines for Solid Phase Synthesis. Tetrahedron Letters, 37, 1101-1104.
- ^ Arnison PG, Bibb MJ, Bierbaum G, Bowers AA, Bugni TS, Bulaj G, Camarero JA, Campopiano DJ, Challis GL, Clardy J, Cotter PD, Craik DJ, Dawson M, Dittmann E, Donadio S, Dorrestein PC, Entian KD, Fischbach MA, Garavelli JS, Göransson U, Gruber CW, Haft DH, Hemscheidt TK, Hertweck C, Hill C, Horswill AR, Jaspars M, Kelly WL, Klinman JP, Kuipers OP, Link AJ, Liu W, Marahiel MA, Mitchell DA, Moll GN, Moore BS, Müller R, Nair SK, Nes IF, Norris GE, Olivera BM, Onaka H, Patchett ML, Piel J, Reaney MJ, Rebuffat S, Ross RP, Sahl HG, Schmidt EW, Selsted ME, Severinov K, Shen B, Sivonen K, Smith L, Stein T, Süssmuth RD, Tagg JR, Tang GL, Truman AW, Vederas JC, Walsh CT, Walton JD, Wenzel SC, Willey JM, van der Donk WA. Ribosomally synthesized and post-translationally modified peptide natural products: overview and recommendations for a universal nomenclature. Nat Prod Rep. 2013, 30 (1): 108–60. PMC 3954855 . PMID 23165928. doi:10.1039/c2np20085f.
- ^ Knerr PJ, van der Donk WA. Discovery, biosynthesis, and engineering of lantipeptides. Annu. Rev. Biochem. 2012, 81: 479–505. PMID 22404629. doi:10.1146/annurev-biochem-060110-113521.