泽布替尼
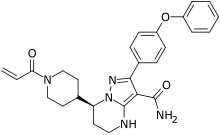
泽布替尼(英语:Zanubrutinib,商品名:百悦泽,英语:Brukinsa)是一种治疗被套细胞淋巴瘤的药物[3],它被定义为一种布鲁顿氏酪氨酸激酶(BTK)抑制剂,并被制作成胶囊,患者通过口服方式服用此药品[4][5]。
 | |
| 临床资料 | |
|---|---|
| 商品名 | 百悦泽 Brukinsa |
| 其他名称 | BGB-3111 |
| AHFS/Drugs.com | Monograph |
| 核准状况 | |
| 给药途径 | 口服给药 |
| 药物类别 | 布鲁顿氏酪氨酸激酶 (BTK) 抑制剂 |
| 法律规范状态 | |
| 法律规范 | |
| 识别信息 | |
| CAS号 | 1691249-45-2 |
| PubChem CID | |
| PubChem SID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| 化学信息 | |
| 化学式 | C27H29N5O3 |
| 摩尔质量 | 471.5509 |
| 3D模型(JSmol) | |
| |
该药品由百济神州研发[6],2012年6月开始立项,2019年11月在美国上市[7][3][8][9],成为首个由中华人民共和国研发的在美国获批上市的抗癌新药。2020年6月3日,该药获准在中国大陆上市[10],成为该国首个上市的由该国生产的BTK抑制剂[11]。
开发过程
编辑百济神州开发团队要先寻找可以模仿 ATP adenine 的杂环,不过,过去已经有诸多文献探讨 BTK 抑制剂的构效关系,开发团队不必从零开始寻找,就以已经上市的 Ibrutinib 开始。然开发团队非直接拿 Ibrutinib 的 pyrazoloadenine 做研究,反而用分子内氢键手法修改 pyrazoloadenine 基团(下图中的 series I),设计出的新化合物,新化合物会在分子内形成氢键,模仿 pyrazoloadenine 基团
有文献指出,使用分子内氢键 (intramolecular hydrogen bond, IMHB) 手法模仿杂环结构可以提高药物水溶解度和穿过细胞膜能力,改善药动特性,亦可提高药物效价(低浓度就可以有强烈药理反应)。在药物设计时,为了提高药物对细胞膜穿透力(药物才能进入细胞发挥作用),便需要提高药物亲脂性,也就是降低药物水溶解度,可能使药物难以做成制剂(举凡针剂等需要溶解于水中),或(如果做成锭剂或胶囊)难以在消化道溶解,阻碍药物吸收(锭剂在肠胃道里要先崩散成颗粒,再溶解成小分子,方能被吸收,因此药物不能太水溶性,也不能太脂溶性),当碰到如此窘境时,可以用 IMHB 手法修饰药物。以 IMHB 修饰的化合物,会存在两种构型(见下图中 B),分别是无分子内氢键 的 “open” 构型(见图十二 B 左)和有分子内氢键的 “close” 构型(见下图中 B 右),两种构型会达成一个平衡。当化合物处于极性环境时(见下图中 A),环境中的极性分子(如水)与化合物之间形成氢键 ,让 “open” 与 “close” 的平衡偏向 “open”,也因为化合物与水形成氢键,让化合物得以溶于水中;相反的,如果化合物处于非极性(见下图中 C),环境中没有分子可以与化合物形成氢键,因而自己在分子内形成氢键,平衡偏向 “close” 构型,使得整个化合物变得偏向亲脂性(因为极性基团被遮蔽)。IMHB 让药物能在不同环境下透过构型改变自己的极性,当在需要溶解于水中时,药物变成亲水性,得以溶于水里;当药物要穿过亲脂性的细胞膜时,药物变成亲脂性,得以穿过细胞膜发挥药效。文献亦指出,透过 IMHB 修改杂环,因为分子内氢键使药物构型也能与杂环一样平坦,不影响药物与蛋白质表面结合。
开发团队合成一系列化合物,结构类似上上图中 series I,并作药理活性评估,这些化合物对 BTK 的效价不错(下图的化合物 I-2),确认 IMHB 在这药物上是可行的
| 化合物 I-2 | 化合物 I-3 |
接着开发团队合成三环化合物(series II),并作药理实验。发现 series II 具有高 BKT 效价与专一性。一开始,团队先合成三环化合物 5,其结构上没有前述说很重要的药效基团 acrylamino,所以它是可逆抑制剂,IC50 (抑制 50% 某个生化功能所需要的药物浓度)17 nM。当把 acrylamino 接上化合物 5 形成化合物 6,IC50 降低到 0.32 nM(只需要比较少的剂量就能达到一半效果),然化合物 6 在老鼠实验上,生体可用率低。团队猜想低生体可用率可能是因为三个芳香环导致的高刚性(芳香环结构是一平面,因此芳香环在药物设计上可以固定药物在特定构型,以方便药物嵌入蛋白质内)。猜测团队的意思是芳香环太多使药物水溶解度不好,影响药物生体可利用率,所以解决办法就是减少芳香环数量,以其他环取代芳香环。
| 化合物 5 | 化合物 6 | 化合物 7 | 化合物 8 | 化合物 9 | 化合物 10 | 化合物 11 | 化合物 12 |
因此团队把其中一个芳香环以脂族环,合成出化合物 8, 9, 10, 11, 和 12。这五个化合物的效价都与化合物 6 相当,且都可以抑制 BTK pY223 (在第 223 位上磷酸化的 BTK,团队要确认药物也能抑制已经活化的 BTK;未活化和已活化的蛋白质,在结构上有些变化,要确认即便结构起了点变化,药物依然能发挥作用)。可惜的是,化合物 5-12,除了化合物 6(选择性七倍),其他化合物对于 EGFR 没有选择性(意即药物不只会抑制 BKT,还会抑制 EGFR)(EGFR IC50/BKT IC50,数字越大,选择性越好)。除了选择性问题外,低药动特性的问题并没有因为把芳香环换成其他脂族环而有所提高,以化合物 8 和 11 为例,在老鼠实验上脾细胞占率分别是 22% 和 44%(团队实验是给老鼠服用每公斤10 毫克剂量,四个小时后看脾脏细胞里的药量;猜测是因为脾脏充满淋巴细胞,因此取脾脏细胞,再加入 BKT 看脾脏内有多少化合物-BKT 复合物,判断有多少药在体内)。
团队认为低药动特性的原因是三环所致高刚性,所以团队合成双环来看问题能不能被解决(前述的双环三环是指两个或三个还连在一起。团队合成以 imidazopyrazole 为主结构的化合物13-16, 化合物 13 和16的 IC50 不错(分别是2.7和 0.13 nM)。其中化合物 13 的选择性最高(77 倍),但效价不如化合物 16,且化合物 16 药动特性仍不理想(脾细胞占率 56%)。
| 化合物 13 | 化合物 14 | 化合物 15 | 化合物 16 |
为解决化合物 16 差药动特性,团队改以 pyrazolopyrimidine 作为杂环合成出化合物 17, IC50 变为 860 nM。团队为了让化合物少一点芳香环的结构与利用双环达到共平面,将化合物 17 还原成化合物 18,IC50 降低到 2.6 nM,进步了将近 300 倍。化合物 18 有两个镜像异构物,将异构物分开后 分别作药理活性实验,18a 的效价稍比18b 高,两者选择性都大于 60 倍。接着团队把前述说的重要药效基团(因为此基团带有攻击性,之后以 ”弹头“ 称之)移到苯环对位,合成出化合物 19,效价降低;弹头移到苯环邻位,合成出化合物 20,其效价比化合物 18 高出四倍。化合物 20 也有两个镜像异构物,20a 的效价比 20b 高达 340 倍之多,但 20a 的选择性就没有如化合物 18 和化合物 19 好。虽然化合物 18a, 18b 和 20a 在药理活性上表现不错,但在老鼠实验上,生体可用率和口服吸收依然低下(20a口服生体可用率1.7%)。
| 化合物 17 | 化合物 18 | 化合物 19 | 化合物 20 | 化合物 21 |
团队以化合物 20 起始,将 phenoxyl 基团换成其他取代物, 试图降低药物脂溶性,以提高口生体可用率,合成出化合物 22-30。取代物包括比较大的基团(化合物 22-23)和比较小的基团(化合物 24-30)。以 cyclopropylmethoxyl (23a), methoxyl (25a) 或 chloride (29a) 取代 20a 的 phenoxyl,在药理活性上并无太大改变;体外实验发现这三个化合物溶解度和对肝脏微粒体稳定度都表现不错(在 pH 7.4下,20a/23a/25a/29a 溶解度33.6/74.7/97.5/83.7 μM)。这三个化合物在老鼠身上,口服生体可用率也有进步(20a/23a/25a/29a:1.7/34.0/24.8/30.6%),药动特性也表现优异(脾细胞81/77/82%)。但他们对 EGFR 的选择性就没如此好。
为了提高选择性以及口服吸收,团队以化合物 20 为始(猜测不用23a,25a或29a的原因可能是可能是修改 phenoxyl 没办法在口服吸收和选择性都合宜,便修改另一个基团看看效果),把其中一个芳香环换成其他脂族环,合成出化合物 31-35。其中,消旋物 31, 32 效价与化合物 20 相当,化合物 34 和 35 的修饰让效价降低 6 倍与 70 倍,表示 cyclopropyl 和 gem-methyl 基团太大,阻碍弹头在适合位置攻击 Cys481。把镜像异构物分开,31a(即 Zanubrutinib), 32a, 33a 在药理活性上表现优异,团队以药物让酵素去活化的速率(kinact)/ 药物抑制速率常数(KI) 评估药物与蛋白质形成共价键的效果,结果显示 31a ≈ Ibrutinib > 31b。接着,团队拿 31a, 32a, 和 33a 与 Rec-1 (被套细胞瘤细胞)cells 做实验,这三个化合物对于抑制细胞 BTK 表现 优异。团队为避免 31a 的抗增生活性是因为它具有毒胞性(就像盐酸可以杀死癌细胞,但不能作为抗癌药),因此拿人类胚胎肾细胞 HEK293 和人类 B 淋巴球细胞瘤 细胞 Ramos cells (非 BTK 依赖的细胞)测试其存活率,实验显示 31a 对这两细胞无毒杀作用。团队再拿 31a 对弥漫性大 B 细胞瘤细胞做实验,其 IC50 (0.35 nM)与 ibrutinib 相当(0.30 nM)。31a 也对 EGFR 有很高的选择性(337 倍)。
团队将 31a 与 BTK 结合,并做 X 光晶体衍射看其与 BTK 的结合情况,并和 ibrutinib 做比较。显然发现,这两个化合物的结合姿态有点不同,与 ibrutinib 同都与 Glu475 (E475) 和 Met477 (M477) 形成氢键,但不同的是 31a 与 Met477 形成两个氢键,比 ibrutinib 多一个。另外,也可以见在 Phe 450,药物的芳香环与之形成 𝜋-𝜋 stacking,有个水分子与 Lys430 和药物的 pyrazolyl 形成氢键。
最后,团队拿 31a, 32a 和 33a 做老鼠实验,发现 31a 相比其他两个化合物,清除率相对低(31a/ 32a/33a:76.8/169/93.9 mL/min/kg)、血中最高浓度高(235/10.4/19.6 ng/mL),曲线下面积 AUC 高( 257/50.3/51.1 h・ng/mL),生体可用率高 (23.6/8.6/5.7 %)。因此拿 31a 做更进一步的实验。
药物合成
编辑参考文献
编辑- ^ Zanubrutinib (Brukinsa) Use During Pregnancy. Drugs.com. 3 January 2020 [26 January 2020]. (原始内容存档于2021-01-17).
- ^ Zanubrutinib. DrugBank. [15 November 2019]. (原始内容存档于2019-11-15).
- ^ 3.0 3.1 U.S. 美国食品药品监督管理局 (FDA) (新闻稿). 缺少或
|title=为空 (帮助) 本文含有此来源中属于公有领域的内容。 - ^ BRUKINSA- zanubrutinib capsule, gelatin coated. DailyMed. 18 November 2019 [28 March 2020]. (原始内容存档于2021-03-19).
- ^ 南方都市报. 淋巴瘤药物泽布替尼国内获批,预计几周内供应患者,称价格有优势. (原始内容存档于2020-06-05).
- ^ 每日经济新闻. 百济神州8年研发对垒巨头 泽布替尼如何挑战全球最畅销同类药物?. (原始内容存档于2020-06-05).
- ^ Drug Approval Package: Brukinsa. U.S. 美国食品药品监督管理局 (FDA). 27 November 2019 [28 March 2020]. (原始内容存档于2019-11-28).
- ^ U.S. 美国食品药品监督管理局 (FDA) (新闻稿). (原始内容使用
|archiveurl=需要含有|url=(帮助)存档于28 November 2019). 缺少或|title=为空 (帮助) 本文含有此来源中属于公有领域的内容。 - ^ Drug Trials Snapshots Brukinsa. U.S. 美国食品药品监督管理局 (FDA). 14 November 2019 [26 January 2020]. (原始内容存档于2021-01-23). 本文含有此来源中属于公有领域的内容。
- ^ 每经网. 百济神州创新药泽布替尼国内获批上市 将与巨头强生直接竞争. (原始内容存档于2020-06-11).
- ^ 新京报. 泽布替尼本土获批,成首款上市的国产BTK抑制剂. (原始内容存档于2020-06-11).
外部链接
编辑- Zanubrutinib. Drug Information Portal. U.S. National Library of Medicine. [2020-06-05]. (原始内容存档于2020-12-06).