Hajos–Parrish–Eder–Sauer–Wiechert反應
Hajos–Parrish–Eder–Sauer–Wiechert反應(Hajos–Parrish[1][2]–Eder–Sauer–Wiechert[3] reaction)
由脯胺酸催化的不對稱羥醛反應。此反應以其在羅氏(Hajos、Parrish)和先靈公司(Eder、Sauer、Wiechert)的早期研究者的名字而命名。這是有機催化的早期例子,也是第一個實現的非金屬催化的羥醛反應。 最早是在20世紀70年代由 Hajos 和 Parrish 發現,如下圖所示:
他們以非手性的三酮作為原料,用天然存在的手性脯胺酸作為催化劑,用3mol%的(S)-(-)-脯氨酸,就可以100%產率和93%ee實現底物的分子內羥醛反應。反應是在二甲基甲醯胺中進行,溫度適中。他們也因此分離出了羥醛加成產物——雙環酮醇。該加成產物最近才有人利用該實驗再次分離出來。[4]
先靈公司的研究組則將反應在非生理條件下進行,以47mol%的(S)-脯氨酸催化,80°C下,在 1N 高氯酸的乙腈溶液中進行反應。他們因此無法分離出酮醇產物,只得到了失水後產生的羥醛縮合產物((7aS)-7a-甲基-2,3,6,7-四氫吲哚-1,5-二酮)。[5]
Hajos 和 Parrish 接下來又用圓二色譜和單晶X射線衍射對上述酮醇產物的結構進行了分析,結果顯示酮醇中的六元環為椅型構象,其中角甲基占據直鍵、羥基占平鍵,與洋地黃糖苷元(digitoxigenin)中CD環的構象類似(左下圖)。[6]但是,酮醇產物的7a-乙基類似物則不然,該分子中乙基處於平鍵、羥基處於直鍵,以避免另一構象中乙基與 C-4 和 C-6 之間更為強烈的1,3-二軸交互作用(右下圖)。
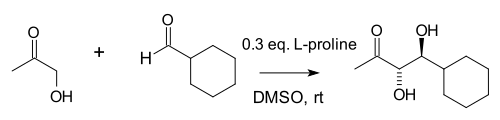
2000年[7][8],List 和 Barbas 等人嘗試用簡單的仲胺來模擬以烯胺活化機理催化羥醛反應的天然Ⅰ型醛縮酶[9],選用(S)-脯氨酸來做丙酮和對硝基苯甲醛的分子間直接羥醛反應,實現了68%產率、76%ee。[10]一般認為這標誌著有機催化復興的開始。 有機催化的分子間羥醛反應也被稱為 List-Barbas 羥醛反應。[11]
上述反應的副反應有酮與脯氨酸生成噁唑啉酮,以及醛與脯氨酸生成亞甲胺葉立德。List 等以高濃度的丙酮作為底物以抑制副反應的發生。 他們還考察了一些脯氨酸的類似物,但是發現大多數催化能力不如脯氨酸,還是最便宜的脯氨酸幾乎是最好的催化劑。 不過5,5-二甲基噻唑-4-羧酸的催化效果也十分良好。[12]
同年 Notz 和 List 又將此反應拓展至鄰二醇的合成:[13]
1985年有人將該反應用於 Wieland-Miescher酮的不對稱合成,利用丁烯酮與2-甲基-1,3-環己二酮先發生麥可加成,然後再在脯氨酸催化下,發生羥醛反應成環製得產物。[14]總過程是一種羅賓遜成環反應。產物 W-M 酮是許多固醇類和萜類化合物的合成前體。 2000年,Barbas 等實現了脯氨酸催化下利用串聯麥可-羥醛反應製取 Wieland-Miescher 酮的不對稱合成。[15]
2002年,美國的 MacMillan(大衛·麥克米蘭)用脯氨酸作催化劑首次實現了不同的醛之間的羥醛反應。克服了做醛的交叉羥醛反應時醛的自身縮合問題。[16]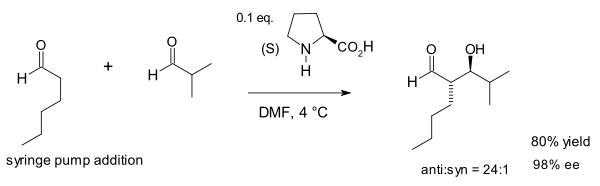
反應機理
編輯有關脯氨酸催化的此反應的機理一直存在爭議。Hajos (1974) 當時提出反應經過酮半縮胺過渡態進行。Agami (1984) 在反應動力學數據基礎上提出烯胺中間體的機理,並且認為在反應過程中,第二個脯氨酸分子參與協助質子轉移。[17]Houk (2001) 提出反應過渡態只含一個脯氨酸分子,而且該脯氨酸的羧基通過氫鍵而與酮羰基作用。[18][19]
Hajos (1974) 機理在最近 Limbach 的實驗中偶然得到支持。[20]Limbach 用 2-甲基-2-(3-氧代丁基)-1,3-環戊二酮作原料,他發現以(S)-(-)-脯氨酸催化時,反應產物是預想中的光學活性雙環酮醇產物((+)-(3aS,7aS)-3a,4,7,7a-四氫-3a-羥基-7a-甲基-1,5(6H)-茚滿二酮);但是以同系的(S)-β-高脯氨酸(吡咯烷-2-基乙酸)催化,產物立體化學特徵則發生逆轉,其ee值甚至可達83%。 這個反常現象可通過認為體積更大的胺基酸從上方來與三酮底物結合來解釋。如果胺基酸是從上方靠近底物,那麼最終產物便是(-)-(3aR,7aR)-3a,4,7,7a-四氫-3a-羥基-7a-甲基-1,5(6H)-茚滿二酮,與由非天然存在的(R)-(+)-脯氨酸催化生成的產物相同。
2000年,List 等以反應立體化學特徵為基礎,提出如下烯胺中間體機理:[10]
他們認為,脯氨酸的氨基和丙酮結合生成亞胺離子,脫去α-氫,生成親核性質的烯胺使親核試劑得到活化。同時脯氨酸的羧基與底物醛的羰基通過氫鍵作用形成一個占優勢的椅型構象,羰基得到活化。然後烯胺優先從 Re 面進攻被活化的羰基,碳-碳鍵的形成與質子轉移同時進行,形成亞胺正離子中間體,再經水解得到產物。
List等使反應在氧-18標記的水(H218O)中進行,發現反應產物也含有氧-18,從而證實了烯胺中間體機理。[21]
同樣經過烯胺中間體的還有 Agami (1984) 機理。2001年,Barbas 等因為無法觀測到 Agami 機理應有的非線性效應而否定了該機理;[12]不過後來(2003年)這個機理又在 List 等的反應動力學數據中得到支持。[22]
此外 List 等[21]還研究了脯氨酸與丙酮在二甲基亞碸中生成的噁唑啉酮的反應:
他們發現脯氨酸與酮在混合後很快發生並達到平衡,丙酮作底物時上述反應的平衡常數為0.12。達到平衡後再加入醛也可得到酮自身羥醛產物或交叉羥醛產物。 因此他們認為 HPESW 反應的機理基本上與噁唑啉酮關係不大。
2004年,Blackmond在脯氨酸催化的丙醛與亞硝基苯的α-苯氨基氧基化反應中,通過NMR,也檢測到了噁唑啉酮中間體的存在。[23]
新加坡的Wong以由脯氨酸衍生出的手性矽醚作為催化劑,研究了丁醛與亞硝基苯之間的類似反應。[24]
他發現,反應中首先生成烯醇,並與催化劑結合。然後,亞硝基苯與該結合物反應,得到羥醛產物,其中主要是亞硝基N參與生成的羥醛產物。這與根據鮑林標度的電負性值做出的預測是相吻合的。 用硼氫化鈉還原羥醛產物,最終以高產率和高對映選擇性得相應的醇,兩種醇產物的比例 PN/PO ≥ 99:1。Wong認為手性矽醚催化的丁醛與亞硝基苯之間的亞硝基N-羥醛反應是經過烯醇中間體進行的,而非烯胺。
2007年,Seebach和Eschenmoser在其47頁的文章中,認為噁唑啉酮實際上是脯氨酸催化機制中很重要的中間體,而非parasitic。[25]例如他們用如下噁唑啉酮與有活化醛基的三氯乙醛反應,得到了羥醛產物:
反應名稱
編輯1985年Agami教授等人首先將脯氨酸催化的 Robinson 成環反應稱為Hajos–Parrish反應。[26]1986年 Kagan 和 Agami 教授在其論文中仍然是使用這一名稱。[27]2001年 Kagan 教授在其名為《不對稱催化中的非線性效應》的文章中,開始用 Hajos–Parrish–Wiechert 反應來稱呼這一反應。[28]2002年,List 教授又加了兩個名字上去,使之成為 Hajos–Parrish–Eder–Sauer–Wiechert 反應。[5]此處使用的是 List (2002) 的名稱。
參見
編輯參考資料
編輯- ^ Z. G. Hajos, D. R. Parrish (1971), German Patent, DE 2102623.
- ^ Hajos, Zoltan G.; Parrish, David R. Asymmetric synthesis of bicyclic intermediates of natural product chemistry. The Journal of Organic Chemistry. 1974-06, 39 (12) [2022-07-21]. ISSN 0022-3263. doi:10.1021/jo00925a003. (原始內容存檔於2021-10-07) (英語).
- ^ Eder, Ulrich; Sauer, Gerhard; Wiechert, Rudolf. New Type of Asymmetric Cyclization to Optically Active Steroid CD Partial Structures. Angewandte Chemie International Edition in English. 1971-07, 10 (7) [2022-07-21]. ISSN 0570-0833. doi:10.1002/anie.197104961. (原始內容存檔於2022-07-21) (英語).
- ^ Kennedy, Jason W. J.; Vietrich, Sophia; Weinmann, Hilmar; Brittain, Dominic E. A. Synthesis of 7a-Substituted Hajos−Wiechert Ketone Analogues. The Journal of Organic Chemistry. 2008-07-01, 73 (13) [2022-07-21]. ISSN 0022-3263. doi:10.1021/jo800638s. (原始內容存檔於2022-07-21) (英語).
- ^ 5.0 5.1 List, Benjamin. Proline-catalyzed asymmetric reactions. Tetrahedron. 2002-07, 58 (28) [2022-07-21]. doi:10.1016/S0040-4020(02)00516-1. (原始內容存檔於2022-06-16) (英語).
- ^ Karle, I. L.; Karle, J. The crystal structure of digitoxigenin, C 23 H 34 O 4. Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 1969-03-01, 25 (3) [2022-07-21]. ISSN 0567-7408. doi:10.1107/S0567740869002391. (原始內容存檔於2018-06-02).
- ^ Rutter, W. J. EVOLUTION OF ALDOLASE. Federation Proceedings. 1964-11, 23 [2022-07-21]. ISSN 0014-9446. PMID 14236133. (原始內容存檔於2022-07-21).
- ^ Barbas, Carlos F. Organocatalysis Lost: Modern Chemistry, Ancient Chemistry, and an Unseen Biosynthetic Apparatus. Angewandte Chemie International Edition. 2008-01, 47 (1) [2022-07-21]. doi:10.1002/anie.200702210. (原始內容存檔於2022-07-21) (英語).
- ^ Wagner, Jürgen; Lerner, Richard A.; Barbas, Carlos F. Efficient Aldolase Catalytic Antibodies That Use the Enamine Mechanism of Natural Enzymes. Science. 1995-12-15, 270 (5243) [2022-07-21]. ISSN 0036-8075. doi:10.1126/science.270.5243.1797. (原始內容存檔於2022-07-21) (英語).
- ^ 10.0 10.1 List, Benjamin; Lerner, Richard A.; Barbas, Carlos F. Proline-Catalyzed Direct Asymmetric Aldol Reactions. Journal of the American Chemical Society. 2000-03-01, 122 (10) [2022-07-21]. ISSN 0002-7863. doi:10.1021/ja994280y. (原始內容存檔於2022-08-05) (英語).
- ^ Ramachary, Dhevalapally B.; Sakthidevi, Rajasekar. Direct Catalytic Asymmetric Synthesis of Highly Functionalized 2-Methylchroman-2,4-diols via Barbas-List Aldol Reaction. Chemistry - A European Journal. 2009-04-27, 15 (18). doi:10.1002/chem.200900066 (英語).
- ^ 12.0 12.1 Sakthivel, Kandasamy; Notz, Wolfgang; Bui, Tommy; Barbas, Carlos F. Amino Acid Catalyzed Direct Asymmetric Aldol Reactions: A Bioorganic Approach to Catalytic Asymmetric Carbon−Carbon Bond-Forming Reactions. Journal of the American Chemical Society. 2001-06-01, 123 (22) [2022-07-21]. ISSN 0002-7863. doi:10.1021/ja010037z. (原始內容存檔於2022-07-21) (英語).
- ^ Notz, Wolfgang; List, Benjamin. Catalytic Asymmetric Synthesis of anti- 1,2-Diols. Journal of the American Chemical Society. 2000-08-01, 122 (30) [2022-07-21]. ISSN 0002-7863. doi:10.1021/ja001460v. (原始內容存檔於2022-07-21) (英語).
- ^ (S)-8a-METHYL-3,4,8,8a-TETRAHYDRO-1,6(2H, 7H)-NAPHTHALENEDIONE. Organic Syntheses. 1985, 63 [2022-07-21]. doi:10.15227/orgsyn.063.0037. (原始內容存檔於2022-07-21).
- ^ Bui, Tommy; Barbas, Carlos F. A proline-catalyzed asymmetric Robinson annulation reaction. Tetrahedron Letters. 2000-09, 41 (36) [2022-07-21]. doi:10.1016/S0040-4039(00)01180-1. (原始內容存檔於2022-06-19) (英語).
- ^ Northrup, Alan B.; MacMillan, David W. C. The First Direct and Enantioselective Cross-Aldol Reaction of Aldehydes. Journal of the American Chemical Society. 2002-06-01, 124 (24) [2022-07-21]. ISSN 0002-7863. doi:10.1021/ja0262378. (原始內容存檔於2022-07-21) (英語).
- ^ Agami, Claude; Meynier, Franck; Puchot, Catherine; Guilhem, Jean; Pascard, Claudine. Stereochemistry-59. Tetrahedron. 1984-01, 40 (6) [2022-07-21]. doi:10.1016/S0040-4020(01)91242-6. (原始內容存檔於2022-06-18) (英語).
- ^ Bahmanyar, S.; Houk, K. N. The Origin of Stereoselectivity in Proline-Catalyzed Intramolecular Aldol Reactions. Journal of the American Chemical Society. 2001-12-01, 123 (51) [2022-07-21]. ISSN 0002-7863. doi:10.1021/ja011714s. (原始內容存檔於2022-07-21) (英語).
- ^ Bahmanyar, S.; Houk, K. N. Transition States of Amine-Catalyzed Aldol Reactions Involving Enamine Intermediates: Theoretical Studies of Mechanism, Reactivity, and Stereoselectivity. Journal of the American Chemical Society. 2001-11-01, 123 (45) [2022-07-21]. ISSN 0002-7863. doi:10.1021/ja011403h. (原始內容存檔於2022-07-21) (英語).
- ^ Limbach, Michael. β-Homoamino acids as catalysts in enantioselective intra- and intermolecular aldol reactions. Tetrahedron Letters. 2006-06, 47 (23) [2022-07-21]. doi:10.1016/j.tetlet.2006.03.183. (原始內容存檔於2022-06-18) (英語).
- ^ 21.0 21.1 List, Benjamin; Hoang, Linh; Martin, Harry J. New mechanistic studies on the proline-catalyzed aldol reaction. Proceedings of the National Academy of Sciences. 2004-04-20, 101 (16) [2022-07-21]. ISSN 0027-8424. PMC 395996 . PMID 15073330. doi:10.1073/pnas.0307979101. (原始內容存檔於2022-07-21) (英語).
- ^ Hoang, Linh; Bahmanyar, S.; Houk, K. N.; List, Benjamin. Kinetic and Stereochemical Evidence for the Involvement of Only One Proline Molecule in the Transition States of Proline-Catalyzed Intra- and Intermolecular Aldol Reactions. Journal of the American Chemical Society. 2003-01-01, 125 (1) [2022-07-21]. ISSN 0002-7863. doi:10.1021/ja028634o. (原始內容存檔於2022-07-21) (英語).
- ^ Iwamura, Hiroshi; Wells, David H.; Mathew, Suju P.; Klussmann, Martin; Armstrong, Alan; Blackmond, Donna G. Probing the Active Catalyst in Product-Accelerated Proline-Mediated Reactions. Journal of the American Chemical Society. 2004-12-01, 126 (50) [2022-07-21]. ISSN 0002-7863. doi:10.1021/ja0444177. (原始內容存檔於2022-07-21) (英語).
- ^ Wong, Chiong Teck. A theoretical investigation on the mechanism of the α,α-diphenylprolinol trimethylsilyl ether-catalyzed oxyamination reaction. Tetrahedron Letters. 2009-02, 50 (7) [2022-07-21]. doi:10.1016/j.tetlet.2008.12.012. (原始內容存檔於2018-06-04) (英語).
- ^ Seebach, Dieter; Beck, Albert K.; Badine, D. Michael; Limbach, Michael; Eschenmoser, Albert; Treasurywala, Adi M.; Hobi, Reinhard; Prikoszovich, Walter; Linder, Bernard. Are Oxazolidinones Really Unproductive, Parasitic Species in Proline Catalysis? – Thoughts and Experiments Pointing to an Alternative View. Helvetica Chimica Acta. 2007-03, 90 (3) [2022-07-21]. doi:10.1002/hlca.200790050. (原始內容存檔於2022-07-21) (英語).
- ^ Agami, Claude; Levisalles, Jacques; Puchot, Catherine. A new diagnostic tool for elucidating the mechanism of enantioselective reactions. Application to the Hajos–Parrish reaction. J. Chem. Soc., Chem. Commun. 1985, (8). ISSN 0022-4936. doi:10.1039/C39850000441 (英語).
- ^ Puchot, C.; Samuel, O.; Dunach, E.; Zhao, S.; Agami, C.; Kagan, H. B. Nonlinear effects in asymmetric synthesis. Examples in asymmetric oxidations and aldolization reactions. Journal of the American Chemical Society. 1986-04, 108 (9) [2022-07-21]. ISSN 0002-7863. doi:10.1021/ja00269a036. (原始內容存檔於2022-07-21) (英語).
- ^ Kagan, Henri B. Nonlinear Effects in Asymmetric Catalysis: A Personal Account. Synlett. 2001, 2001 (Special Issue) [2022-08-07]. doi:10.1055/s-2001-14660. (原始內容存檔於2018-06-04).