Hajos–Parrish–Eder–Sauer–Wiechert反应
Hajos–Parrish–Eder–Sauer–Wiechert反应(Hajos–Parrish[1][2]–Eder–Sauer–Wiechert[3] reaction)
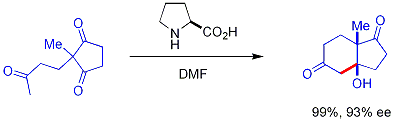
由脯胺酸催化的不对称羟醛反应。此反应以其在罗氏(Hajos、Parrish)和先灵公司(Eder、Sauer、Wiechert)的早期研究者的名字而命名。这是有机催化的早期例子,也是第一个实现的非金属催化的羟醛反应。 最早是在20世纪70年代由 Hajos 和 Parrish 发现,如下图所示:
他们以非手性的三酮作为原料,用天然存在的手性脯胺酸作为催化剂,用3mol%的(S)-(-)-脯氨酸,就可以100%产率和93%ee实现底物的分子内羟醛反应。反应是在二甲基甲酰胺中进行,温度适中。他们也因此分离出了羟醛加成产物——双环酮醇。该加成产物最近才有人利用该实验再次分离出来。[4]
先灵公司的研究组则将反应在非生理条件下进行,以47mol%的(S)-脯氨酸催化,80°C下,在 1N 高氯酸的乙腈溶液中进行反应。他们因此无法分离出酮醇产物,只得到了失水后产生的羟醛缩合产物((7aS)-7a-甲基-2,3,6,7-四氢吲哚-1,5-二酮)。[5]
Hajos 和 Parrish 接下来又用圆二色谱和单晶X射线衍射对上述酮醇产物的结构进行了分析,结果显示酮醇中的六元环为椅型构象,其中角甲基占据直键、羟基占平键,与洋地黄糖苷元(digitoxigenin)中CD环的构象类似(左下图)。[6]但是,酮醇产物的7a-乙基类似物则不然,该分子中乙基处于平键、羟基处于直键,以避免另一构象中乙基与 C-4 和 C-6 之间更为强烈的1,3-二轴交互作用(右下图)。
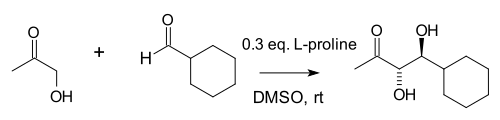
2000年[7][8],List 和 Barbas 等人尝试用简单的仲胺来模拟以烯胺活化机理催化羟醛反应的天然Ⅰ型醛缩酶[9],选用(S)-脯氨酸来做丙酮和对硝基苯甲醛的分子间直接羟醛反应,实现了68%产率、76%ee。[10]一般认为这标志着有机催化复兴的开始。 有机催化的分子间羟醛反应也被称为 List-Barbas 羟醛反应。[11]
上述反应的副反应有酮与脯氨酸生成噁唑啉酮,以及醛与脯氨酸生成亚甲胺叶立德。List 等以高浓度的丙酮作为底物以抑制副反应的发生。 他们还考察了一些脯氨酸的类似物,但是发现大多数催化能力不如脯氨酸,还是最便宜的脯氨酸几乎是最好的催化剂。 不过5,5-二甲基噻唑-4-羧酸的催化效果也十分良好。[12]
同年 Notz 和 List 又将此反应拓展至邻二醇的合成:[13]
1985年有人将该反应用于 Wieland-Miescher酮的不对称合成,利用丁烯酮与2-甲基-1,3-环己二酮先发生麦克尔加成,然后再在脯氨酸催化下,发生羟醛反应成环制得产物。[14]总过程是一种罗宾逊成环反应。产物 W-M 酮是许多固醇类和萜类化合物的合成前体。 2000年,Barbas 等实现了脯氨酸催化下利用串联麦克尔-羟醛反应制取 Wieland-Miescher 酮的不对称合成。[15]
2002年,美国的 MacMillan(大卫·麦克米兰)用脯氨酸作催化剂首次实现了不同的醛之间的羟醛反应。克服了做醛的交叉羟醛反应时醛的自身缩合问题。[16]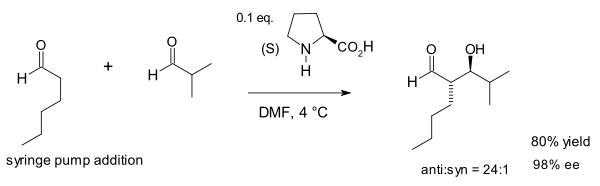
反应机理
编辑有关脯氨酸催化的此反应的机理一直存在争议。Hajos (1974) 当时提出反应经过酮半缩胺过渡态进行。Agami (1984) 在反应动力学数据基础上提出烯胺中间体的机理,并且认为在反应过程中,第二个脯氨酸分子参与协助质子转移。[17]Houk (2001) 提出反应过渡态只含一个脯氨酸分子,而且该脯氨酸的羧基通过氢键而与酮羰基作用。[18][19]
Hajos (1974) 机理在最近 Limbach 的实验中偶然得到支持。[20]Limbach 用 2-甲基-2-(3-氧代丁基)-1,3-环戊二酮作原料,他发现以(S)-(-)-脯氨酸催化时,反应产物是预想中的光学活性双环酮醇产物((+)-(3aS,7aS)-3a,4,7,7a-四氢-3a-羟基-7a-甲基-1,5(6H)-茚满二酮);但是以同系的(S)-β-高脯氨酸(吡咯烷-2-基乙酸)催化,产物立体化学特征则发生逆转,其ee值甚至可达83%。 这个反常现象可通过认为体积更大的氨基酸从上方来与三酮底物结合来解释。如果氨基酸是从上方靠近底物,那么最终产物便是(-)-(3aR,7aR)-3a,4,7,7a-四氢-3a-羟基-7a-甲基-1,5(6H)-茚满二酮,与由非天然存在的(R)-(+)-脯氨酸催化生成的产物相同。
2000年,List 等以反应立体化学特征为基础,提出如下烯胺中间体机理:[10]
他们认为,脯氨酸的氨基和丙酮结合生成亚胺离子,脱去α-氢,生成亲核性质的烯胺使亲核试剂得到活化。同时脯氨酸的羧基与底物醛的羰基通过氢键作用形成一个占优势的椅型构象,羰基得到活化。然后烯胺优先从 Re 面进攻被活化的羰基,碳-碳键的形成与质子转移同时进行,形成亚胺正离子中间体,再经水解得到产物。
List等使反应在氧-18标记的水(H218O)中进行,发现反应产物也含有氧-18,从而证实了烯胺中间体机理。[21]
同样经过烯胺中间体的还有 Agami (1984) 机理。2001年,Barbas 等因为无法观测到 Agami 机理应有的非线性效应而否定了该机理;[12]不过后来(2003年)这个机理又在 List 等的反应动力学数据中得到支持。[22]
此外 List 等[21]还研究了脯氨酸与丙酮在二甲基亚砜中生成的噁唑啉酮的反应:
他们发现脯氨酸与酮在混合后很快发生并达到平衡,丙酮作底物时上述反应的平衡常数为0.12。达到平衡后再加入醛也可得到酮自身羟醛产物或交叉羟醛产物。 因此他们认为 HPESW 反应的机理基本上与噁唑啉酮关系不大。
2004年,Blackmond在脯氨酸催化的丙醛与亚硝基苯的α-苯氨基氧基化反应中,通过NMR,也检测到了噁唑啉酮中间体的存在。[23]
新加坡的Wong以由脯氨酸衍生出的手性硅醚作为催化剂,研究了丁醛与亚硝基苯之间的类似反应。[24]
他发现,反应中首先生成烯醇,并与催化剂结合。然后,亚硝基苯与该结合物反应,得到羟醛产物,其中主要是亚硝基N参与生成的羟醛产物。这与根据鲍林标度的电负性值做出的预测是相吻合的。 用硼氢化钠还原羟醛产物,最终以高产率和高对映选择性得相应的醇,两种醇产物的比例 PN/PO ≥ 99:1。Wong认为手性硅醚催化的丁醛与亚硝基苯之间的亚硝基N-羟醛反应是经过烯醇中间体进行的,而非烯胺。
2007年,Seebach和Eschenmoser在其47页的文章中,认为噁唑啉酮实际上是脯氨酸催化机制中很重要的中间体,而非parasitic。[25]例如他们用如下噁唑啉酮与有活化醛基的三氯乙醛反应,得到了羟醛产物:
反应名称
编辑1985年Agami教授等人首先将脯氨酸催化的 Robinson 成环反应称为Hajos–Parrish反应。[26]1986年 Kagan 和 Agami 教授在其论文中仍然是使用这一名称。[27]2001年 Kagan 教授在其名为《不对称催化中的非线性效应》的文章中,开始用 Hajos–Parrish–Wiechert 反应来称呼这一反应。[28]2002年,List 教授又加了两个名字上去,使之成为 Hajos–Parrish–Eder–Sauer–Wiechert 反应。[5]此处使用的是 List (2002) 的名称。
参见
编辑参考资料
编辑- ^ Z. G. Hajos, D. R. Parrish (1971), German Patent, DE 2102623.
- ^ Hajos, Zoltan G.; Parrish, David R. Asymmetric synthesis of bicyclic intermediates of natural product chemistry. The Journal of Organic Chemistry. 1974-06, 39 (12) [2022-07-21]. ISSN 0022-3263. doi:10.1021/jo00925a003. (原始内容存档于2021-10-07) (英语).
- ^ Eder, Ulrich; Sauer, Gerhard; Wiechert, Rudolf. New Type of Asymmetric Cyclization to Optically Active Steroid CD Partial Structures. Angewandte Chemie International Edition in English. 1971-07, 10 (7) [2022-07-21]. ISSN 0570-0833. doi:10.1002/anie.197104961. (原始内容存档于2022-07-21) (英语).
- ^ Kennedy, Jason W. J.; Vietrich, Sophia; Weinmann, Hilmar; Brittain, Dominic E. A. Synthesis of 7a-Substituted Hajos−Wiechert Ketone Analogues. The Journal of Organic Chemistry. 2008-07-01, 73 (13) [2022-07-21]. ISSN 0022-3263. doi:10.1021/jo800638s. (原始内容存档于2022-07-21) (英语).
- ^ 5.0 5.1 List, Benjamin. Proline-catalyzed asymmetric reactions. Tetrahedron. 2002-07, 58 (28) [2022-07-21]. doi:10.1016/S0040-4020(02)00516-1. (原始内容存档于2022-06-16) (英语).
- ^ Karle, I. L.; Karle, J. The crystal structure of digitoxigenin, C 23 H 34 O 4. Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 1969-03-01, 25 (3) [2022-07-21]. ISSN 0567-7408. doi:10.1107/S0567740869002391. (原始内容存档于2018-06-02).
- ^ Rutter, W. J. EVOLUTION OF ALDOLASE. Federation Proceedings. 1964-11, 23 [2022-07-21]. ISSN 0014-9446. PMID 14236133. (原始内容存档于2022-07-21).
- ^ Barbas, Carlos F. Organocatalysis Lost: Modern Chemistry, Ancient Chemistry, and an Unseen Biosynthetic Apparatus. Angewandte Chemie International Edition. 2008-01, 47 (1) [2022-07-21]. doi:10.1002/anie.200702210. (原始内容存档于2022-07-21) (英语).
- ^ Wagner, Jürgen; Lerner, Richard A.; Barbas, Carlos F. Efficient Aldolase Catalytic Antibodies That Use the Enamine Mechanism of Natural Enzymes. Science. 1995-12-15, 270 (5243) [2022-07-21]. ISSN 0036-8075. doi:10.1126/science.270.5243.1797. (原始内容存档于2022-07-21) (英语).
- ^ 10.0 10.1 List, Benjamin; Lerner, Richard A.; Barbas, Carlos F. Proline-Catalyzed Direct Asymmetric Aldol Reactions. Journal of the American Chemical Society. 2000-03-01, 122 (10) [2022-07-21]. ISSN 0002-7863. doi:10.1021/ja994280y. (原始内容存档于2022-08-05) (英语).
- ^ Ramachary, Dhevalapally B.; Sakthidevi, Rajasekar. Direct Catalytic Asymmetric Synthesis of Highly Functionalized 2-Methylchroman-2,4-diols via Barbas-List Aldol Reaction. Chemistry - A European Journal. 2009-04-27, 15 (18). doi:10.1002/chem.200900066 (英语).
- ^ 12.0 12.1 Sakthivel, Kandasamy; Notz, Wolfgang; Bui, Tommy; Barbas, Carlos F. Amino Acid Catalyzed Direct Asymmetric Aldol Reactions: A Bioorganic Approach to Catalytic Asymmetric Carbon−Carbon Bond-Forming Reactions. Journal of the American Chemical Society. 2001-06-01, 123 (22) [2022-07-21]. ISSN 0002-7863. doi:10.1021/ja010037z. (原始内容存档于2022-07-21) (英语).
- ^ Notz, Wolfgang; List, Benjamin. Catalytic Asymmetric Synthesis of anti- 1,2-Diols. Journal of the American Chemical Society. 2000-08-01, 122 (30) [2022-07-21]. ISSN 0002-7863. doi:10.1021/ja001460v. (原始内容存档于2022-07-21) (英语).
- ^ (S)-8a-METHYL-3,4,8,8a-TETRAHYDRO-1,6(2H, 7H)-NAPHTHALENEDIONE. Organic Syntheses. 1985, 63 [2022-07-21]. doi:10.15227/orgsyn.063.0037. (原始内容存档于2022-07-21).
- ^ Bui, Tommy; Barbas, Carlos F. A proline-catalyzed asymmetric Robinson annulation reaction. Tetrahedron Letters. 2000-09, 41 (36) [2022-07-21]. doi:10.1016/S0040-4039(00)01180-1. (原始内容存档于2022-06-19) (英语).
- ^ Northrup, Alan B.; MacMillan, David W. C. The First Direct and Enantioselective Cross-Aldol Reaction of Aldehydes. Journal of the American Chemical Society. 2002-06-01, 124 (24) [2022-07-21]. ISSN 0002-7863. doi:10.1021/ja0262378. (原始内容存档于2022-07-21) (英语).
- ^ Agami, Claude; Meynier, Franck; Puchot, Catherine; Guilhem, Jean; Pascard, Claudine. Stereochemistry-59. Tetrahedron. 1984-01, 40 (6) [2022-07-21]. doi:10.1016/S0040-4020(01)91242-6. (原始内容存档于2022-06-18) (英语).
- ^ Bahmanyar, S.; Houk, K. N. The Origin of Stereoselectivity in Proline-Catalyzed Intramolecular Aldol Reactions. Journal of the American Chemical Society. 2001-12-01, 123 (51) [2022-07-21]. ISSN 0002-7863. doi:10.1021/ja011714s. (原始内容存档于2022-07-21) (英语).
- ^ Bahmanyar, S.; Houk, K. N. Transition States of Amine-Catalyzed Aldol Reactions Involving Enamine Intermediates: Theoretical Studies of Mechanism, Reactivity, and Stereoselectivity. Journal of the American Chemical Society. 2001-11-01, 123 (45) [2022-07-21]. ISSN 0002-7863. doi:10.1021/ja011403h. (原始内容存档于2022-07-21) (英语).
- ^ Limbach, Michael. β-Homoamino acids as catalysts in enantioselective intra- and intermolecular aldol reactions. Tetrahedron Letters. 2006-06, 47 (23) [2022-07-21]. doi:10.1016/j.tetlet.2006.03.183. (原始内容存档于2022-06-18) (英语).
- ^ 21.0 21.1 List, Benjamin; Hoang, Linh; Martin, Harry J. New mechanistic studies on the proline-catalyzed aldol reaction. Proceedings of the National Academy of Sciences. 2004-04-20, 101 (16) [2022-07-21]. ISSN 0027-8424. PMC 395996 . PMID 15073330. doi:10.1073/pnas.0307979101. (原始内容存档于2022-07-21) (英语).
- ^ Hoang, Linh; Bahmanyar, S.; Houk, K. N.; List, Benjamin. Kinetic and Stereochemical Evidence for the Involvement of Only One Proline Molecule in the Transition States of Proline-Catalyzed Intra- and Intermolecular Aldol Reactions. Journal of the American Chemical Society. 2003-01-01, 125 (1) [2022-07-21]. ISSN 0002-7863. doi:10.1021/ja028634o. (原始内容存档于2022-07-21) (英语).
- ^ Iwamura, Hiroshi; Wells, David H.; Mathew, Suju P.; Klussmann, Martin; Armstrong, Alan; Blackmond, Donna G. Probing the Active Catalyst in Product-Accelerated Proline-Mediated Reactions. Journal of the American Chemical Society. 2004-12-01, 126 (50) [2022-07-21]. ISSN 0002-7863. doi:10.1021/ja0444177. (原始内容存档于2022-07-21) (英语).
- ^ Wong, Chiong Teck. A theoretical investigation on the mechanism of the α,α-diphenylprolinol trimethylsilyl ether-catalyzed oxyamination reaction. Tetrahedron Letters. 2009-02, 50 (7) [2022-07-21]. doi:10.1016/j.tetlet.2008.12.012. (原始内容存档于2018-06-04) (英语).
- ^ Seebach, Dieter; Beck, Albert K.; Badine, D. Michael; Limbach, Michael; Eschenmoser, Albert; Treasurywala, Adi M.; Hobi, Reinhard; Prikoszovich, Walter; Linder, Bernard. Are Oxazolidinones Really Unproductive, Parasitic Species in Proline Catalysis? – Thoughts and Experiments Pointing to an Alternative View. Helvetica Chimica Acta. 2007-03, 90 (3) [2022-07-21]. doi:10.1002/hlca.200790050. (原始内容存档于2022-07-21) (英语).
- ^ Agami, Claude; Levisalles, Jacques; Puchot, Catherine. A new diagnostic tool for elucidating the mechanism of enantioselective reactions. Application to the Hajos–Parrish reaction. J. Chem. Soc., Chem. Commun. 1985, (8). ISSN 0022-4936. doi:10.1039/C39850000441 (英语).
- ^ Puchot, C.; Samuel, O.; Dunach, E.; Zhao, S.; Agami, C.; Kagan, H. B. Nonlinear effects in asymmetric synthesis. Examples in asymmetric oxidations and aldolization reactions. Journal of the American Chemical Society. 1986-04, 108 (9) [2022-07-21]. ISSN 0002-7863. doi:10.1021/ja00269a036. (原始内容存档于2022-07-21) (英语).
- ^ Kagan, Henri B. Nonlinear Effects in Asymmetric Catalysis: A Personal Account. Synlett. 2001, 2001 (Special Issue) [2022-08-07]. doi:10.1055/s-2001-14660. (原始内容存档于2018-06-04).