诱导性多能干细胞
诱导性多能干细胞(英语:Induced pluripotent stem cell),又称人工诱导多能干细胞,常简称为iPS细胞(iPSC),是一种由哺乳动物成体细胞经转入转录因子等手段脱分化形成的多能干细胞,最早由日本学者山中伸弥的研究团队于2006年发现[1]。山中伸弥团队在发表iPS诱导技术时使用之实验材料为小鼠细胞。2007年,研究人员又证明iPS诱导技术可以应用于人体细胞[2]。最初由山中伸弥团队发现的诱导方法是通过慢病毒载体将Oct4、Sox2、c-Myc、Klf4四种转录因子基因转入成体细胞将其转化为类似于胚胎干细胞的多能干细胞。其后,研究人员又先后发现了更优化的诱导方法,如使用质粒载体转染、腺病毒感染、脂质粒导入等非基因组整合的方法进行诱导[3]、通过细胞融合诱导[4]、使用小分子药物进行诱导[5]、转入miRNA(微干扰RNA)进行诱导[6]等。
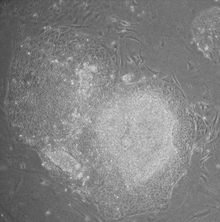
iPS细胞与胚胎干细胞拥有相似的再生能力,理论上可以分化为成体的所有器官、组织。而相比胚胎干细胞,iPS细胞面临的伦理道德争议较小,且应用该技术可以产生基因型与移植受体完全相同的干细胞,规避了排异反应的风险,因而iPS细胞在一定程度上冲击了胚胎干细胞在再生医学中的地位,被认为在再生医学及组织工程方面拥有较为广阔的应用前景,有望为治愈糖尿病、关节炎等疾病提供新的思路。同时,iPS细胞在新药开发、疾病模型构建领域也有望得到应用。但iPS诱导技术同样面临着诱导效率低、用于治疗可能存在长期风险等挑战[7][8][9][10]。
制备方法
编辑最初由山中伸弥团队发现的iPS细胞制备(诱导)方法是以通过慢病毒载体转入数个转录因子为核心,在导入四种转录因子后,小鼠的成纤维细胞经过一定时间就会转变为状态类似于胚胎干细胞的iPS细胞[1]。
使用这种方法制备iPS细胞,首先需要一个特殊的转基因小鼠品系。这种转基因小鼠的Fbx15基因下游转入了一个βgeo元件。该元件由β-半乳糖苷酶基因和新霉素抗性基因(NeoR)融合而成。如果基因表达环境与胚胎干细胞相似,Fbx15基因就会表达。而在一般的成体细胞中,Fbx15基因表达处于关闭状态。对这种品系的转基因小鼠来说,细胞如果处于一种与胚胎干细胞相似的状态,Fbx15基因下游的βgeo元件也随Fbx15基因会一同表达,βgeo元件中的NeoR基因会使这种细胞获得对药物G-418的抗性,而一般的体细胞仍然对G-418敏感。加入G-418后,对G-418敏感的成体细胞会死亡,而与胚胎干细胞状态相似的细胞因具有G-418抗性,会在筛选中存活[1][12]。
后续实验用到的小鼠胚胎成纤维细胞(MEF)或尾尖成纤维细胞(TTF)均来自上述的转基因小鼠品系。在得到该品系小鼠的成纤维细胞后,需要制备分别含有Oct4、Sox2、c-Myc、Klf4基因的四种慢病毒载体。之后,再用这四种慢病毒载体感染成纤维细胞。用于实验的成纤维细胞已与有G-418抗性的胚胎干细胞饲养层细胞混合,以维持可能会在后续实验中产生的iPS细胞的干性。如果感染成功,这四种基因就会在成体细胞中表达。感染后,需要将细胞培养基更换为含有G-418的胚胎干细胞培养基。细胞如果回到类似胚胎干细胞的状态,会因NeoR基因的表达于含G-418的培养基中存活,而未回到类似胚胎干细胞状态的成纤维细胞会死亡。饲养层细胞因带有G-418抗性,也会在这个过程中存活。经过7天左右,可以观察到有细胞形成类似胚胎干细胞的细胞集落,这些细胞就是诱导产生的iPS细胞。再经过一段时间的生长,待细胞集落足够大时,即可挑选合适的集落进行转移,经过多代培养后形成稳定的iPS细胞系[1][13]。
在山中伸弥于2006年发表关于iPS诱导技术的文章后,2007年,研究人员成功将iPS技术应用于人成体细胞,制得人源性的iPS细胞,方法与山中伸弥团队的制备方法有少许不同[8][14]。其后,研究人员又先后成功制备了山羊、绵羊、大鼠、猪、猫、兔、狗、狼等哺乳动物的iPS细胞[4]。同时,亦发现除成纤维细胞外,其他类型的成体细胞以及成体干细胞均可以重编程为iPS细胞[8][15][16][15]。不过,不同细胞重编程到iPS细胞的效率存在差异。一般来说,分化程度越低的细胞越容易被重编程为iPS细胞[17][18][19]。同时,研究人员也对重编程的方法进行了一定改良。比如,已有使用腺相关病毒载体感染、质粒载体转染、脂质粒转入等非基因组整合技术为核心的重编程方法[3]。亦有研究表明,只通过转入特定miRNA(微干扰RNA)就可以使细胞重编程为iPS细胞[6]。将成体细胞与胚胎干细胞的细胞质融合,也可以使其重编程为iPS细胞[4]。只通过加入多种小分子药物的混合物,亦可达到将成体细胞重编程为iPS细胞的目的[5]。一些实验结果表明,通过改变转入的转录因子等方法,可以在一定程度上提高iPS的重编程效率[4]。
性质
编辑iPS细胞性质与胚胎干细胞相似,但在一些方面又存在差异[8][1][20]。培养iPS细胞的环境与胚胎干细胞相似。传统的培养方法是将iPS细胞培养在经丝裂霉素或射线灭活的小鼠胚层成纤维细胞(MEF)组成的饲养层(feeder)上,并使用含有血清及白血病抑制因子(LIF)的培养基中[1][13]。目前亦已有方法可以将iPS细胞培养在化学成分明确的无血清培养基上,且不需要使用饲养层细胞的培养方法[21]。
iPS细胞在体外具有无限增殖的潜能,也能形成与胚胎干细胞相似的紧致、平坦的细胞集落。iPS细胞在体外培养时,形态也与胚胎干细胞接近:细胞呈圆形,细胞核体积大、细胞质体积相对较小。同时,iPS细胞也表达一些胚胎干细胞中的干细胞标志物,比如Nanog蛋白、SSEA类蛋白、TRA类蛋白[8][1]。iPS细胞具有分化为三个胚层细胞或组织的潜力[1][22]:76-77。iPS细胞在注射入免疫缺陷性个体后,可以生成畸胎瘤[22]:321,体外悬浮培养的iPS会分化形成类胚体(embryoid body,EB)[23]。但iPS形成嵌合体(chimera)的能力较差,甚至使用iPS细胞产生嵌合体小鼠的尝试曾一度失败[22]:321[20]。此外,iPS细胞形成的细胞集落是异质性的,一部分iPS细胞集落中的细胞与胚胎干细胞存在较大差异,可从形态和是否表达Dlk1-Dio3等标志物将这个集落区分出来。从形态正常的细胞集落中挑选的iPS细胞的基因表达模式和胚胎干细胞基本相似,但亦存在一定差异。分析表明,一些基因的表达情况在iPS细胞中和胚胎干细胞中存在持久性的差异[20]。
历史
编辑1950年代,英国发育生物学家约翰·格登的一系列实验表明,将蟾蜍成体细胞的细胞核移入去除细胞核的卵细胞后,这个重组的细胞可以发育为一个完整的蟾蜍个体。这一发现否定了此前一度流行的一个学说:细胞在分化的过程中会不断丢弃不需要的遗传物质。约翰·格登的实验证明动物成体细胞仍然拥有全套基因组,有发育成完整个体的潜力[24]:5-6[9]。
iPS细胞诱导技术的发现者山中伸弥于1999年入职日本奈良先端科学技术大学院大学(NAIST)担任副教授。在1999年至2003年间,他提出了通过转入外源性因子使体细胞重编程为干细胞的猜想,并与博士后高桥和利开始了相关的研究[25]。2003年,山中伸弥得到了大阪大学教授岸本忠三的支持,获得科学技术振兴机构5年3亿日圆的经费支持。同年,山中伸弥升为正教授[25]。2004年,山中伸弥转任京都大学教授[26]。
山中伸弥团队最初选择了24个候选基因,并制备了分别含有这24个候选基因的慢病毒载体。最初,山中伸弥的团队同时将这24种慢病毒载体转入小鼠的成纤维细胞中,发现有部分细胞回到了与胚胎干细胞类似的状态,并形成了细胞集落。在经过几次重复实验确认结果的可靠性后,山中伸弥团队又在这24种基因中进行了进一步筛选,最终确认了一组最佳的组合:当同时向成体细胞转入Oct4、Sox2、c-Myc、Klf4四种转录因子时,就能有细胞转化为多能性干细胞。2006年,山中伸弥团队发表了他们的这一实验结果[27][24]:15-17。在山中伸弥发表这篇论文后,实验结果的真实性曾一度遭到同行的质疑。2007年4月,美国生物学家鲁道夫·耶尼施首次表示山中伸弥的实验是可重复的。随后,其他课题组也先后重复出山中伸弥的实验[24]:17-19。同年,研究人员成功使用人的成体细胞取得人源性的iPS细胞[8]。之后,研究人员又成功制备了山羊、大鼠、狗等哺乳动物的iPS细胞[4]。
在山中伸弥团队宣布发现iPS细胞后,iPS细胞很快成为生命科学领域研究的热门。根据统计,仅2006年到2009年之间,就有300余篇关于iPS细胞的论文发表[27]。iPS细胞诱导技术的发现者山中伸弥于2012年与约翰·格登爵士一同获得了诺贝尔生理医学奖[11]。同年,京都大学教授高桥政代与山中伸弥合作,计划展开一项使用iPS细胞治疗黄斑部退化的临床试验。在该试验中,会先用患者的体细胞产生iPS细胞,然后再令取得的iPS细胞分化为视网膜色素上皮细胞。最后,将得到的视网膜色素上皮细胞用于修复患者的视网膜。2014年,该计划正式进入临床试验阶段,成为全球首个进入临床试验阶段的iPS细胞相关治疗方案。试验开始后,研究团队曾一度宣布实验进展顺利,患者的病情得到了缓解,视力也有了提高。但最后因为发现iPS细胞和分化的细胞基因组中存在两处变异,研究团队于2015年宣布停止这项临床试验[27][28]。2016年3月,高桥政代团队又进行了一次移植手术,将重编程自正常人体细胞的iPS细胞重新分化为视网膜色素上皮细胞,并将之移植入一名黄斑部退化患者的眼部。移植手术本身是成功的,但后续报导表明,患者在手术后产生了严重的不良反应[29][30][31]。
挑战与应用前景
编辑iPS细胞性质与胚胎干细胞相似,且相比胚胎干细胞会面临较少的伦理学争议,因而iPS细胞被认为在组织工程及再生医学、药物开发、疾病模型构建等领域有较广阔的发展前景[8][9]。但另一方面,iPS细胞的诱导技术仍有一些不成熟之处,iPS细胞在得到真正的临床应用前,还需要解决一些关键性的问题[8][20][32]。
挑战
编辑iPS诱导技术处于快速发展时期,还有许多不够成熟的地方[8]。首先,iPS细胞的部分性质与胚胎干细胞存在差异,如iPS形成嵌合体的能力较弱[22]:321[20]。此外,iPS相比胚胎干细胞较难分化为成体细胞[19]。因为诱导iPS细胞需要人为导入外源性因子,细胞的表观遗传状态也可能会因此出现异常。如果应用iPS细胞作为细胞替代疗法的材料,可能会存在长期的风险[22]:6-7:78。有研究表明,iPS细胞的成瘤性比胚胎干细胞强许多[33]。另一方面,iPS细胞的诱导技术还面临诱导效率低的问题。一般认为这是因为体细胞重编程到多能干细胞的过程中,会遇到一些“屏障”。比如,导入的基因难以与表达处于关闭状态的下游的基因发生相互作用[8][19]。简而言之,如果想要将iPS细胞用于临床疗法中,需要满足以下几个条件:确保能高效、安全地取得iPS细胞;确保iPS细胞能分化为目的细胞;确保病人不会产生不良反应[19][32]。另外,来自不同细胞集落的iPS细胞间存在差异。如果想要将iPS细胞应用于新药开发中,就必须要想办法控制这些差异,以保证不同批次的实验组间不存在显著的无关变量[19]。
应用前景
编辑iPS细胞因为可以用于细胞替代疗法而受到关注[24]:20-22。目前,已成功将iPS分化成了来自三个胚层的不同细胞和组织[10]。另外,已成功在小鼠体内用iPS细胞修复了受损的视网膜和血管[34][35]。研究人员对基于iPS细胞的细胞替代疗法的设想是,使用病人的成体细胞产生与病人基因型一致的iPS细胞,再于体外诱导产生所需的器官,最后通过移植手术将产生的器官植入病人体内,使病人机体受损的功能得以恢复。因为使用的细胞基因型与病人相同,移植手术后理论上不会产生排异反应[8][19][32]。利用这样的细胞替代疗法,有望治愈因细胞受损而产生的疾病,比如由胰岛B细胞受损引发的1型糖尿病、由血管内皮细胞受损引发的心血管疾病等。同时,亦可用来产生移植手术所需要的器官[19][32][10]。美国国防部已批准了包括用iPS细胞产生血液的研究在内的几项基金。有设想认为可以用iPS构建不同血型的iPS细胞库,为战争伤员或病人源源不断供应血液[24]:20-22。
iPS细胞亦可以应用于新药开发中。比如,可以用iPS细胞在体外分化出成体细胞,再用药物处理分化的成体细胞,用以预测这些药物在实际应用到体内后是否会令使用者产生不良反应[27][32][19][36]。此外,亦可以使用iPS细胞进行疾病模型的构建。即用病人的iPS细胞构建状态异常的成体细胞或组织。这样的成体细胞或组织可用作相关疾病的研究模型。目前,研究人员有计划用iPS细胞建立一个疾病模型库[37][37][38]。
参见
编辑参考文献
编辑- ^ 1.0 1.1 1.2 1.3 1.4 1.5 1.6 1.7 1.8 Takahashi, K; Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 2006, 126 (4): 663–76. PMID 16904174. doi:10.1016/j.cell.2006.07.024.
- ^ Takahashi, K; et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell, 131(5), 861–872. 2007.
- ^ 3.0 3.1 Yi-ye Zhou; Fanyi Zeng. Integration-free Methods for Generating Induced Pluripotent Stem Cells. Genomics Proteomics Bioinformatics. 2013 Oct; 11(5): 284–287.
- ^ 4.0 4.1 4.2 4.3 4.4 Jong Soo Kim; et al. Reprogrammed Pluripotent Stem Cells from Somatic Cells. Int J Stem Cells. 2011 Jun; 4(1): 1–8.
- ^ 5.0 5.1 Xiaojie Ma; Linghao Kong; Saiyong Zhu. Reprogramming cell fates by small molecules. Protein Cell. 2017 May; 8(5): 328–348.
- ^ 6.0 6.1 Anokyedanso, Frederick; et al. Highly efficient miRNA-mediated reprogramming of mouse and human somatic cells to pluripotency. Cell Stem Cell 8.4(2011):376.
- ^ Harvey Lodish; et al. Chapter 21. Molecular Cell Biology (7th edition). Macmillan Higher Education. 2013: 979–983. ISBN 978-1-4641-0981-2.
- ^ 8.00 8.01 8.02 8.03 8.04 8.05 8.06 8.07 8.08 8.09 8.10 Robert Lanza; et al. The Essential of Stem Cell Biology (2nd edition). San Diego: Elsevier. 2009: xxi–xxii. ISBN 978-0-12-374729-7.
- ^ 9.0 9.1 9.2 Kazutoshi Takahashi; Shinya Yamanaka. Induced pluripotent stem cells in medicine and biology. Development 2013 140: 2457-2461.
- ^ 10.0 10.1 10.2 Vimal Selvaraj; et al. Switching cell fate: the remarkable rise of iPS cells and lineage reprogramming technologies. Trends Biotechnol. 2010 Apr; 28(4): 214–223.
- ^ 11.0 11.1 The Nobel Prize in Physiology or Medicine 2012. NobelPrize.org. 2012-10-08 [2012-10-08]. (原始内容存档于2017-04-26).
- ^ Yanhong Shi. Induced pluripotent stem cells, new tools for drug discovery and new hope for stem cell therapies. Curr Mol Pharmacol. 2009 Jan; 2(1): 15–18.
- ^ 13.0 13.1 Kazutoshi Takahashi; et al. Induction of pluripotent stem cells from fibroblast cultures. Nature Protocols. 2007, 2 (12).
- ^ In-Hyun Park; et al. Generation of human-induced pluripotent stem cells. Nature Protocols. 2008, 3 (7).
- ^ 15.0 15.1 Melissa Helen Little. Kidney Development, Disease, Repair and Regeneration. Elsevier Science. 2015-08-06: 493– [2018-01-28]. ISBN 978-0-12-800438-8. (原始内容存档于2021-05-02).
- ^ Jeong Beom Kim; et al. Generation of induced pluripotent stem cells from neural stem cells. Nature Protocols volume4, pages1464–1470 (2009).
- ^ Niibe Kunimichi; et al. Purified Mesenchymal Stem Cells Are an Efficient Source for iPS Cell Induction. Plos One 6.3(2011):e17610.
- ^ J Yee. Turning Somatic Cells into Pluripotent Stem Cells. Nature Education. 2010, 3 (9): 25 [2018-01-28]. (原始内容存档于2017-05-30).
- ^ 19.0 19.1 19.2 19.3 19.4 19.5 19.6 19.7 Charles A. Goldthwaite. The Promise of Induced Pluripotent Stem Cells (iPSCs). NIH. [2018-01-28]. (原始内容存档于2017-10-29).
- ^ 20.0 20.1 20.2 20.3 20.4 Bilic J; Izpisua Belmonte JC. Concise review: Induced pluripotent stem cells versus embryonic stem cells: close enough or yet too far apart?. Stem Cells. 2012 Jan;30(1):33-41.
- ^ Guokai Chen; et al. Chemically defined conditions for human iPS cell derivation and culture. Nat Methods. 2011 May; 8(5): 424–429.
- ^ 22.0 22.1 22.2 22.3 22.4 Tarik Regad; et al. Principles of Stem Cell Biology and Cancer. Wiley Blackwell. 2015: 3–5. ISBN 978-1-118-67062-0.
- ^ Yongshun Lin; Guokai Chen. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors.. Stembook.
- ^ 24.0 24.1 24.2 24.3 24.4 内莎·凯里(Nessa Carey)著 贾乙、王亚菲译. 遺傳的革命:表觀遺傳學將改變我們對生命的理解. 重庆出版社. 2011. ISBN 978-7-229-10427-6.
- ^ 25.0 25.1 山中氏ノーベル賞:「難病治したい」繰り返した挫折、再起. 毎日新闻. 2012-10-08 [2012-10-08]. (原始内容存档于2012-10-10).
- ^ Shinya Yamanaka. nobelprize.org. 2014 [2018-01-28]. (原始内容存档于2018-01-27).
- ^ 27.0 27.1 27.2 27.3 Megan Scudellari. How iPS cells changed the world. Nature News&Reviews. 2016 [2018-01-28]. (原始内容存档于2018-01-09).
- ^ Garber, Ken. RIKEN suspends first clinical trial involving induced pluripotent stem cells. Nature Biotechnology: 890–891. PMID 26348942. doi:10.1038/nbt0915-890.
- ^ Takahashi M. Retinal Cell Therapy Using iPS Cells. Nippon Ganka Gakkai Zasshi. 2016 Mar;120(3):210-24; discussion 225.
- ^ First donor iPSC-derived RPE cell transplantation in AMD patient. RIKEN Center for Developmental Biology. 2017-04-04 [2017-09-06]. (原始内容存档于2017-04-18).
- ^ First serious adverse reaction to iPS-derived retinal cell transplant reported. The Japan Times. 2018-01-17 [2018-01-28]. (原始内容存档于2018-01-27).
- ^ 32.0 32.1 32.2 32.3 32.4 VII. What are the potential uses of human stem cells and the obstacles that must be overcome before these potential uses will be realized?. Stem Cell Basics. NIH. [2018-01-28]. (原始内容存档于2018-01-22).
- ^ Ivan Gutierrez-Aranda.; et al. Human Induced Pluripotent Stem Cells Develop Teratoma More Efficiently and Faster than Human Embryonic Stem Cells Regardless of the Site of Injection. Stem Cells. 2010, 28 (9): 1568–1570. PMC 2996086 . PMID 20641038. doi:10.1002/stem.471.
- ^ Mullin, Emily. Researchers repair retinas in mice with virus-free stem cells. fiercebiotech.com. 2014-01-28 [2014-02-17]. (原始内容存档于2014-02-22).
- ^ Zambidis, Elias; Lutty, Gerard; Park, Tea Soon; Bhutto, Imran; et al. Vascular Progenitors From Cord Blood-Derived Induced Pluripotent Stem Cells Possess Augmented Capacity for Regenerating Ischemic Retinal Vasculature. Circulation (American Heart Association). 2014, 129 (3): 359–372 [2018-01-28]. PMC 4090244 . PMID 24163065. doi:10.1161/CIRCULATIONAHA.113.003000. (原始内容存档于2014-02-27).
- ^ Shinnawi, Rami; Huber, I; Maizels, L; Shaheen, N; Gepstein, A; Arbel, G; Tijsen, A; Gepstein, L. Monitoring human-induced pluripotent stem cell-derived cardiomyocytes with genetically encoded calcium and voltage fluorescent reporters.. Stem Cell Reports. 2015, 5 (4): 582–596. PMC 4624957 . PMID 26372632. doi:10.1016/j.stemcr.2015.08.009.
- ^ 37.0 37.1 Grskovic, M; Javaherian, A; Strulovici, B; Daley, GQ. Induced pluripotent stem cells--opportunities for disease modelling and drug discovery.. Nature Reviews. Drug Discovery. 2011-11-11, 10 (12): 915–29. PMID 22076509. doi:10.1038/nrd3577.
- ^ Gerlin, Andrea. Roche, Pfizer, Sanofi Plan $72.7 Million Stem-Cell Bank. Bloomberg.com. 2012-12-05 [2018-01-28]. (原始内容存档于2017-02-11).
外部链接
编辑