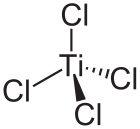
四氯化钛
四氯化钛,或氯化钛(IV),是化学式为 TiCl4 的无机化合物。
| 四氯化钛 | |||
|---|---|---|---|
| |||

| |||
| IUPAC名 Titanium tetrachloride Titanium(IV) chloride | |||
| 识别 | |||
| CAS号 | 7550-45-0 | ||
| PubChem | 24193 | ||
| ChemSpider | 22615 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | XJDNKRIXUMDJCW-FOGBWSKZAG | ||
| UN编号 | 1838 | ||
| EINECS | 231-441-9 | ||
| RTECS | XR1925000 | ||
| MeSH | Titanium+tetrachloride | ||
| 性质 | |||
| 化学式 | TiCl4 | ||
| 摩尔质量 | 189.71 g·mol⁻¹ | ||
| 外观 | 无色发烟液体 | ||
| 密度 | (液体) 1.730 g/cm3 | ||
| 熔点 | −24 °C | ||
| 沸点 | 136.4 °C | ||
| 溶解性(水) | 分解[1] | ||
| 溶解性 | 可溶于二氯甲烷、[2]甲苯[3]和戊烷[4] | ||
| 结构 | |||
| 分子构型 | 四面体 | ||
| 偶极矩 | 0 | ||
| 热力学 | |||
| ΔfHm⦵298K | −763 kJ·mol−1[5] | ||
| S⦵298K | 355 J·mol−1·K−1[5] | ||
| 危险性[6] | |||
GHS危险性符号  
| |||
| GHS提示词 | Danger | ||
| H-术语 | H314, H317, H318, H330, H335, H370, H372 | ||
| P-术语 | P280, P301+330+331, P304+340, P305+351+338, P308+310 | ||
| NFPA 704 | |||
| 相关物质 | |||
| 其他阴离子 | 四氟化钛 四溴化钛 四碘化钛 | ||
| 其他阳离子 | 四氯化锆 四氯化铪 | ||
| 相关化学品 | 二氯化钛 三氯化钛 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
四氯化钛是生产金属钛及其化合物的重要中间体。室温下,四氯化钛为无色液体,并在空气中发烟,生成二氧化钛固体和盐酸液滴的混合物。
性质及结构
编辑四氯化钛是无色密度大的液体,样品不纯时常为黄或红棕色。与四氯化钒类似,它属于少数在室温时为液态的过渡金属氯化物之一,其熔沸点之低与弱的分子间作用力有关。大多数金属氯化物都为聚合物,含有氯桥连接的金属原子,而四氯化钛分子间作用力却主要为弱的范德华力,因此熔沸点不高。
TiCl4 分子为四面体结构,每个 Ti4+ 与四个配体 Cl− 相连。Ti4+ 与稀有气体氩具有相同的电子数,为闭壳层结构。因此四氯化钛分子为正四面体结构,具有高度的对称性。TiCl4的结构类似TiBr4和TiI4,而这三种化合物有许多相似的地方。TiCl4和TiBr4会反应,形成混合卤化物TiCl4−xBrx,其中x = 0、1、2、3、4。磁共振测量还表明在TiCl4和VCl4之间的卤化物交换也很快。[7]
TiCl4 可溶于非极性的甲苯和氯代烃中。研究表明溶解在某些芳香烃的过程中涉及类似于 [(C6R6)TiCl3]+ 配合物的生成。[来源请求]四氯化钛可与路易斯碱溶剂(如 THF)放热反应,生成六配位的加合物。[8] 对于体积较大的配体,产物则是五配位的TiCl4L。
生产
编辑TiCl4 可通过氯化法制备。具体过程是,900 °C 时用碳在氯气氛围中与钛氧化物矿物(如钛铁矿和金红石)反应,蒸馏纯化产物。
TiCl4 并不昂贵,通常用于实验室用途。
应用
编辑钛金属生产
编辑二氧化钛生产
编辑大约 90% 的 TiCl4 都被用于制造钛白颜料(TiO2 ),该过程主要是四氯化钛的水解反应:
- TiCl4 + O2 → TiO2 + 2Cl2
烟雾剂
编辑过去曾用四氯化钛来制造烟幕。露置在空气中时,四氯化钛会迅速与空气中的水反应:
- TiCl4 + 2H2O → TiO2 + 4HCl
生成的氯化氢会迅速吸收更多的水,生成细小的盐酸液滴;而当空气中的湿度更大时,更大的盐酸液滴则会产生更好的散射效果。而且生成的白色二氧化钛粉末也是很好的散射质。
由于盐酸具有腐蚀性,现在已不再使用 TiCl4 作烟雾剂。
化学反应
编辑有机金属化学及无机化学
编辑- TiCl4 是很强的路易斯酸。其水解反应既体现了它电子接受体的特性,涉及中间体 TiCl4(H2O) 。四氯化钛可与 THF 反应生成黄色的 TiCl4(THF)2 ,继续与 Cl− 反应则生成 [Ti2Cl9]−、[Ti2Cl10]2− 和 [TiCl6]2− 。[10] 有趣的是,TiCl4 与氯离子的反应与相应的正离子有关,譬如四氯化钛与 NBu4Cl 反应得到五配位的 NBu4TiCl5 ,而与体积小的 NEt4Cl 反应则得到 (NEt4)2Ti2Cl10 。这些反应体现了静电引力对离子性很强的化合物的影响。
- 有机钛化学基本上都是以 TiCl4 作原料。其中比较重要的包括四氯化钛与环戊二烯基钠生成二氯化二环戊二烯基钛(Titanocene dichloride ,TiCl2(C5H5)2 )的反应。产物又被称为特伯试剂(二氯化二环戊二烯基钛与三甲基铝形成的配位化合物)。芳香烃类,如六甲基苯 C6(CH3)6 ,与四氯化钛反应生成夹心配合物 [Ti(C6(CH3)6)Cl3]+ ,[11] 体现了用更强的路易斯酸试剂 AlCl3 与四氯化钛反应衍生出的 TiCl3+ 的强路易斯酸性。
有机合成试剂
编辑- 在 Mukaiyama 羟醛反应中涉及了 TiCl4 与电子给予体(醛)的反应(生成类似于 (RCHO)TiCl4OC(H)R 的加合物)。
- 在 McMurry 反应中使用锌、四氯化钛和氢化铝锂(或其它还原剂)作催化剂,完成醛或酮的还原二聚生成烯烃。
烯烃聚合反应
编辑四氯化钛及其许多衍生物都可作为制取齐格勒-纳塔催化剂的前体。机理可能是:[15]
还原
编辑毒性及安全
编辑四氯化钛在空气中强烈水解并发烟,其危险也一般与生成的氯化氢有关。四氯化钛也是强路易斯酸,会与路易斯碱(甚至弱路易斯碱)放热反应形成加合物,与水则爆炸性反应。
参考资料
编辑- ^ Eremenko, B. V.; Bezuglaya, T. N.; Savitskaya, A. N.; Malysheva, M. L.; Kozlov, I. S.; Bogodist, L. G. Stability of Aqueous Dispersions of the Hydrated Titanium Dioxide Prepared by Titanium Tetrachloride Hydrolysis. Colloid Journal. 2001, 63 (2): 173–178. S2CID 93971747. doi:10.1023/A:1016673605744.
- ^ titanium(IV) chloride, 1M soln. in dichloromethane. Alfa Aesar. Alfa Aesar. [7 March 2018]. (原始内容存档于2019-09-27).
- ^ Titanium(IV) chloride solution 1.0 M in toluene. Sigma-Aldrich. [7 March 2018].
- ^ Butts, Edward H De. patent US3021349A. [2021-12-23]. (原始内容存档于2021-12-23).
- ^ 5.0 5.1 Zumdahl, Steven S. Chemical Principles 6th. Houghton-Mifflin. 2009: A23. ISBN 978-0-618-94690-7.
- ^ Classifications - CL Inventory. echa.europa.eu. [2021-12-23]. (原始内容存档于2016-12-02).
- ^ Webb, S. P.; Gordon, M. S. Intermolecular Self-Interactions of the Titanium Tetrahalides TiX4 (X = F, Cl, Br). J. Am. Chem. Soc. 1999, 121 (11): 2552–2560 [2021-12-23]. doi:10.1021/ja983339i. (原始内容存档于2021-05-15).
- ^ L. E. Manzer. Tetrahydrofuran Complexes of Selected Early Transition Metals. Inorganic Synthesis. 1982, 21: 135–40.
- ^ S. P. Webb, M. S. Gordon. Intermolecular Self-Interactions of the Titanium Tetrahalides TiX4 (X = F, Cl, Br). J. Am. Chem. Soc. 1999, 121: 2552–2560. doi:10.1021/ja983339i.
- ^ C. S. Creaser , J. A. Creighton. Pentachloro- and Pentabromotitanate(IV) ions. Journal of the Chemical Society, Dalton Transactions. 1975: 1402–1405. doi:10.1039/DT9750001402.
- ^ F. Calderazzo, I. Ferri, G. Pampaloni, S. Troyanov. η6-Arene Derivatives of Titanium(IV), Zirconium(IV) and Hafnium(IV). Journal of Organometallic Chemistry. 1996, 518: 189–196. doi:10.1016/0022-328X(96)06194-3.
- ^ D. C. Bradey, M. Thomas. Some Dialkylamino-derivatives of Titanium and Zirconium. Journal of the Chemical Society. 1960: 3857–3861. doi:10.1039/JR9600003857.
- ^ M. E. Davie, T. Foerster, S. Parsons, C. Pulham, D. W. H. Rankin, B. A. Smart. The Crystal Structure of Tetrakis(dimethylamino)titanium(IV). Polyhedron. 2006, 25: 923–929. doi:10.1016/j.poly.2005.10.019.
- ^ L.-L. Gundersen, F. Rise, K. Undheim. Titanium(IV) chloride. Encyclopedia of Reagents for Organic Synthesis L. Paquette. New York: J. Wiley & Sons. 2004.
- ^ Allegra G. (1971). "Discussion on the Mechanism of Polymerization of a- Olefins with Ziegler-Natta Catalysts". Die Makromolekulare Chemie 145 (3668): 235-246. doi:10.1002/macp.1971.021450119. Cossee, P. J. (1964). "Ziegler-Natta catalysis I. Mechanism of polymerization of α-olefins with Ziegler-Natta catalysts". J. Catal. 3 (1): 80 - 89. doi:10.1016/0021-9517(64)90095-8. Arlman, E. J. (1964). "Ziegler-Natta catalysis II. Surface structure of layer-lattice transition metal chlorides". J. Catal. 3 (1): 89 - 99. doi:10.1016/0021-9517(64)90096-X. Arlman, E. J.; Cossee, P. (1964). "Ziegler-Natta catalysis III. Stereospecific polymerization of propene with the catalyst system TiCl3---AlEt3". J. Catal. 3 (1): 99 - 104. doi:10.1016/0021-9517(64)90097-1.
深层阅读
编辑- Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements, 2nd Edition, Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.