四氯化锆
化合物
四氯化锆,是一种锆化合物,并且是多种锆盐的前体。
| 四氯化锆 | |
|---|---|
| |

| |
| IUPAC名 Zirconium tetrachloride Zirconium(IV) chloride | |
| 识别 | |
| CAS号 | 10026-11-6 |
| PubChem | 24817 |
| ChemSpider | 23202 |
| SMILES |
|
| InChI |
|
| InChIKey | DUNKXUFBGCUVQW-XBHQNQODAQ |
| EINECS | 233-058-2 |
| ChEBI | 77566 |
| 性质 | |
| 化学式 | ZrCl4 |
| 摩尔质量 | 233.04 g/mol g·mol⁻¹ |
| 外观 | 白色易潮解晶体 |
| 密度 | 2.80 g/cm3 |
| 熔点 | 437 °C(710 K)((三相点)) |
| 沸点 | 331 °C(604 K)((升华)) |
| 溶解性(水) | 水解 |
| 溶解性 | 溶于乙醇,醚和浓盐酸 |
| 结构 | |
| 晶体结构 | 单斜, mP10 |
| 空间群 | P12/c1, No. 13 |
| 热力学 | |
| ΔfHm⦵298K | −980.52 kJ/mol |
| S⦵298K | 181.41 J K−1 mol−1 |
| 热容 | 125.38 J K−1 mol−1 |
| 危险性 | |
| MSDS | MSDS |
| 欧盟编号 | 未列出 |
| 闪点 | 不可燃 |
| 致死量或浓度: | |
LD50(中位剂量)
|
1688 mg/kg(大鼠,口服) |
| 相关物质 | |
| 其他阴离子 | 四氟化锆 四溴化锆 四碘化锆 |
| 其他阳离子 | 四氯化钛 四氯化铪 |
| 相关化学品 | 二氯化锆 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
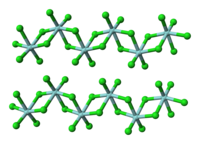
结构
编辑与四氯化钛不同,固态的ZrCl4中存在着以锆原子为中心的含有氯桥连接的八面体配位结构。这也就解释了它们在熔点上的巨大差异。这种结构还出现在HfCl4中。当使用路易斯碱进行处理时,Zr-Cl-Zr形式的氯桥会断裂,从而使聚合物分解。[1]例如,四氯化锆可以和含羟基的配体发生氯置换反应,和水反应可生成ZrOCl2。[2]
制备
编辑性质和用途
编辑四氯化锆是一种弱的路易斯酸,能与五氯化磷形成加合物ZrCl4·PCl5和ZrCl4·2PCl5,或和碱金属或碱土金属氯化物形成六氯锆酸盐。[2]此外,它还可以代替三氯化铝参与傅-克反应和狄尔斯–阿尔德反应。[3]
四氯化锆是用于对二氧化锆和二硼化锆进行化学气相沉积的最重要的前体。[4]它还被用作纺织品防水剂、皮革鞣剂、分析试剂。[2]
参考文献
编辑- ^ N. N. Greenwood & A. Earnshaw, Chemistry of the Elements (2nd ed.), Butterworth-Heinemann, Oxford, 1997.
- ^ 2.0 2.1 2.2 2.3 周公度. 《化学辞典》. 北京: 化学工业出版社. 2004. ISBN 7-5025-4409-7.
- ^ Bora U. Zirconium Tetrachloride. Synlett. 2003, (7): 1073–1074. doi:10.1055/s-2003-39323.
- ^ Randich, E. Chemical vapor deposited borides of the form (Ti,Zr)B2 and (Ta,Ti)B2. Thin Solid Films. 1 November 1979, 63 (2): 309–313. doi:10.1016/0040-6090(79)90034-8.