依那西普
依那西普(英语:Etanercept),目前有以Enbrel(恩博) 等商品名称销售,是种生物制药,有肿瘤坏死因子抑制剂作用,可干扰肿瘤坏死因子(TNF,一种可溶性促炎细胞因子,旧称肿瘤坏死因子-α(TNF-α))来治疗自体免疫性疾病,经美国食品药物管理局 (FDA) 批准用于治疗类风湿性关节炎、幼年特发性关节炎和干癣性关节炎、干癣和强直性脊柱炎。肿瘤坏死因子是造成许多器官系统发炎(免疫)反应的"主调节因子"。自体免疫性疾病是由个体本身过度活跃的免疫反应所引起。依那西普可透过抑制TNF而达到治疗的目的。[13]]
 | |
| 临床资料 | |
|---|---|
| 商品名 | Enbrel(恩博) |
| 生物相似药 | Etanercept-szzs, Etanercept-ykro, Benepali, Erelzi, Etacept, Etera,[1] Eticovo, Lifmior, Nepexto,[2] Rymti[3] |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a602013 |
| 核准状况 |
|
| 怀孕分级 | |
| 给药途径 | 皮下注射 |
| ATC码 | |
| 法律规范状态 | |
| 法律规范 | |
| 药物动力学数据 | |
| 生物利用度 | 58–76% (SC,口服生物利用率) |
| 生物半衰期 | 70–132小时 |
| 识别信息 | |
| CAS号 | 185243-69-0 |
| PubChem SID | |
| DrugBank | |
| ChemSpider |
|
| UNII | |
| KEGG | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.224.383 |
| 化学信息 | |
| 化学式 | C2224H3475N621O698S36 |
| 摩尔质量 | 51,235.07 g·mol−1 |
依那西普是种由重组DNA产生的融合蛋白,将TNF受体融合到免疫球蛋白G1 (IgG1)抗体的恒定端。开发人员首先将编码人类可溶性TNF受体2(CD120)基因的DNA序列分离,CD120是一种可与肿瘤坏死因子结合的受体。他们接着分离出编码人类免疫球蛋白G1Fc端基因的DNA序列。第三个步骤是他们将TNF受体2的DNA与IgG1 Fc的DNA连接。他们最后表达(转录)连接的DNA,以产生一种蛋白质,此蛋白质可将TNF受体2的蛋白质与IgG1 Fc的蛋白质连接。[14]
这种原型融合蛋白是由在美国达拉斯德克萨斯大学西南医学中心担任学术研究员的布鲁斯·比尤特勒及其同事在1990年代初首次合成,并被证明是种高度活跃且异常稳定的活体内TNF抑制剂。[15][16]
这群研究人员将其发现申请专利,[17]并将所有使用权利出售给一家名为Immunex的公司(一家位于西雅图的生物技术公司),而Immunex于2002年被安进制药公司收购。[18]
依那西普是种大型分子,分子重量为150道尔顿(kDa),可与TNF结合,而降低其在人类和其他动物中发生过度发炎的作用,包括自体免疫性疾病,如强直性脊柱炎、[19]幼年特发性关节炎、干癣、干癣性关节炎、类风湿性关节炎,以及由过量TNF所介导的各种不同疾病。这种药物已被列入世界卫生组织基本药物标准清单中。[20]
医疗用途
编辑在美国,依那西普适用的症状有:
- 中度至重度类风湿性关节炎 (RA)(1998年11月)[10][21]
- 中度至重度多关节性幼年特发性关节炎(1999年5月)[10][22]
- 干癣性关节炎(2002年1月)[10][23]
- 强直性脊柱炎 (AS)(2003年7月)[10][24][25]
- 中度至重度干癣(2004年4月)[10][26]
在欧盟,依那西普适用的症状有:
- 中度至重度活跃性类风湿性关节炎[11]
- 严重、活跃性和迈进性类风湿性关节炎[11]
- 幼年特发性关节炎[11]
- 儿童和青少年的多关节炎(类风湿因子阳性或阴性)和扩展性寡关节炎[11]
- 活跃性和迈进性干癣关节炎[11]
- 著骨点炎相关性关节炎
- 中轴型脊柱关节炎[11]
- 严重活跃性强直性脊柱炎[11]
- 严重非放射性中轴型脊柱关节炎[11]
- 中度至重度干癣[11]
- 慢性严重干癣与小儿干癣[11]
未受承认的用途
编辑一位名为爱德华·托比尼克(Edward Tobinick)的美国医生尝试使用依那西普治疗中风和脑损伤后患者的慢性神经功能障碍,[27]并借此取得美国[28]以及外国专利。美国神经内科医师及哈佛大学教授史蒂文·诺维拉在《基于科学的医学》杂志上撰文表示,"医生在其能力和专业领域范围外执业是不道德的行为"。托比尼克为此对诺维拉提起诉讼,而最终败诉。[29]美国神经病学会对于此种治疗的建议是"无足够的证据以确定其有效性,且此种治疗方式可能会带来不良后果及巨大成本"。[30]
不良影响
编辑FDA因为该药物引起一些严重的感染,而曾在2008年5月2日对依那西普发出黑框警告。[31]根据报导,使用依那西普会导致严重感染和败血症(包括潜伏性结核和乙型肝炎感染复发),甚至是死亡。[10][32]
作用机转
编辑依那西普可降低天然生成TNF的作用,因此是种TNF抑制剂(一种可与TNF结合的诱饵受体)。[34]
TNF是种由淋巴球和巨噬细胞(两种均为白血球中的成分)产生的细胞激素,可透过吸引额外的白血球到发炎部位,以及透过引发和放大发炎的额外分子机制来介导免疫反应。依那西普能抑制TNF作用而将发炎反应减少,此对于治疗自体免疫性疾病特别有用。
TNF受体有两种:一种嵌入白血球中,透过释放其他细胞激素对TNF作出反应,另一种是可溶性TNF受体,用于导致TNF失去活性并减弱免疫反应。此外,几乎所有有核细胞的表面都有TNF受体(无核的红血球表面不含TNF受体)。依那西普可模仿天然存在的可溶性TNF受体所具的抑制作用。但依那西普不同之处是其为一种融合蛋白,而非单纯的TNF受体,因此在血液中的半衰期可大幅延长,有较深入且时间较长的作用。比天然存在的可溶性TNF受体有更持久的生物效应。[35]
结构
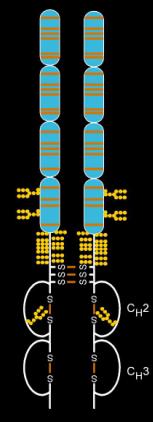
编辑依那西普由两种天然存在的可溶性人类75千道尔顿TNF受体与IgG1 Fc部分连接而成。[36]其作用是人工设计的二聚体融合蛋白。[36]依那西普是一种复杂分子,含有6个N-聚糖、最多14个O-聚糖和29个二硫化物桥结构。[37][38][39]
历史
编辑第一个与依那西普相关的专利由Immunex于1989年9月5日提交。[40]这种原型融合蛋白是由当时在美国达拉斯德克萨斯大学西南医学中心担任学术研究员的布鲁斯·比尤特勒及其同事在1990年代初首次合成,并获得专利,而于1995年将所有使用权利出售给Immunex。[41]于麻省总医院服务的研究人员Brian Seed所发现的另一融合蛋白质技术也取得专利,并于于1997年将其授权给Immmunex。[42]
依那西普于1998年11月在美国获准作医疗用途。[10][43]
此药物于2000年2月在欧盟获准使用。[11]
社会与文化
编辑经济学
编辑依那西普于美国的零售价随着时间演进而持续上涨。 患者于2008年支付的费用为每月1,500美元(即每年18,000美元)。[44]到2011年,费用已超过每年20,000美元。[45][46]一家英国伦敦的医疗保险公司 - 国际健康计划联合会 (International Federation of Health Plans,简称IFHP) 于2013年所做的调查发现,美国患者于依那西普的平均费用为每月2,225美元,即每年26,700美元。[47]IFHP报告中显示美国各种健康计划的收费价格差异很大,患者中从第25个百分位数的1,946美元到第95个百分位数的4,006美元不等。[47]
在美国,依那西普的售价比其他国家为贵。[47]截至2013年,接受调查的国家的平均每月费用从瑞士的1,017美元到加拿大的1,646美元不等,而美国的平均每月费用为2,225美元。[47]
安进在美国和加拿大境内销售依那西普,而辉瑞在两国以外的国家和地区销售该药物。[45]于2010年,美国和加拿大的销售额为35亿美元,[45]同一年度在前述两国以外的销售额则为33亿美元。[48]
专利
编辑依那西普的专利原定于2012年10月23日到期,[49]但该药物在美国因取得第二项专利,又取得16年的独占权。[50]
在第二项专利到期之前,依那西普的通用名药物(又称学名药)似乎不太可能出现。依那西普是生物制剂,与化学制剂适用的法律不同,许多国家不允许生产生物制剂的学名药。然而欧盟,以及美国,由美国国会通过,由巴拉克·奥巴马总统签署的《2009年生物制品价格竞争和创新法案(Biologics Price Competition and Innovation Act of 2009)》)已制定批准生物制药学名药(生物相似药)的措施,但要求参与者须"实施强制临床测试和定期审查"。[51]
印度大型制药公司西普拉有限公司于2013年4月宣布在印度推出首款依那西普生物相似药(与中国上海中信国健药业有限公司(Shanghai CP Guojian Pharmaceutical Co. Ltd.)合作生产),商品名为Etacept,用于治疗风湿性疾病。[52][53]
生物相似药
编辑以下有数种依那西普生物相似药获准作医疗用途:
2016年1月,Benepali被批准在欧盟使用。[54]
2017年2月,Lifmior获准在欧盟使用。[55]但于2020年2月由市场撤出。[56]
2017年6月,Erelzi获准在欧盟使用。[57]
2019年3月,YLB113(由日本YL Biologics公司生产的依那西普生物类似药)获准在日本使用。[58]
2020年5月,Nepexto获准在欧盟使用。[2]
相似药物
编辑- 可溶性抗肿瘤坏死因子受体
- Pegsunercept(此药物仍在研究阶段中)
- 抗肿瘤坏死因子单克隆抗体
参考文献
编辑- ^ 1.0 1.1 1.2 Etera ARTG. Therapeutic Goods Administration (TGA). [2021-06-12]. (原始内容存档于2021-06-13).
- ^ 2.0 2.1 2.2 Nepexto EPAR. European Medicines Agency. 24 March 2020 [2023-03-04]. (原始内容存档于2020-06-04).
- ^ 3.0 3.1 3.2 Rymti ARTG. Therapeutic Goods Administration (TGA). [2021-06-12]. (原始内容存档于2021-06-13).
- ^ 4.0 4.1 Australian Public Assessment Report for Etanercept (PDF). Feb 2021 [2024-01-11]. (原始内容存档 (PDF)于2024-01-14).
- ^ Etanercept Use During Pregnancy. Drugs.com. 2020-01-24 [2020-08-13]. (原始内容存档于2021-01-20).
- ^ Rymti Summary Basis of Decision. Health Canada. 2014-10-23 [2023-03-10]. (原始内容存档于2023-05-27).
- ^ Benepali 25 mg solution for injection in pre-filled syringe - Summary of Product Characteristics (SmPC). (emc). 2021-01-25 [2021-06-12]. (原始内容存档于2023-12-28).
- ^ Enbrel 25mg solution for injection in pre-filled pen - Summary of Product Characteristics (SmPC). (emc). 2021 -06-08 [2021-06-12]. (原始内容存档于2023-12-28).
- ^ Erelzi 50 mg solution for injection in pre filled pen - Summary of Product Characteristics (SmPC). (emc). 2021-05-25 [2021-06-12]. (原始内容存档于2024-02-27).
- ^ 10.0 10.1 10.2 10.3 10.4 10.5 10.6 10.7 Enbrel- etanercept solution Enbrel- etanercept kit. DailyMed. [2021-04-17]. (原始内容存档于2024-02-28).
- ^ 11.00 11.01 11.02 11.03 11.04 11.05 11.06 11.07 11.08 11.09 11.10 11.11 Enbrel EPAR. European Medicines Agency (EMA). 2018-09-17 [2020-04-02]. (原始内容存档于2020-11-12). Text was copied from this source which is © European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
- ^ Nepexto Product information. Union Register of medicinal products. [2023-03-03]. (原始内容存档于2023-03-05).
- ^ Feldmann M, Maini RN. Lasker Clinical Medical Research Award. TNF defined as a therapeutic target for rheumatoid arthritis and other autoimmune diseases. Nature Medicine. October 2003, 9 (10): 1245–1250. PMID 14520364. S2CID 52860838. doi:10.1038/nm939.
- ^ Drugs@FDA: FDA-Approved Drugs. [2024-01-11]. (原始内容存档于2024-04-18).
- ^ Peppel K, Crawford D, Beutler B. A tumor necrosis factor (TNF) receptor-IgG heavy chain chimeric protein as a bivalent antagonist of TNF activity. The Journal of Experimental Medicine. December 1991, 174 (6): 1483–1489. PMC 2119031 . PMID 1660525. doi:10.1084/jem.174.6.1483.
- ^ Peppel K, Poltorak A, Melhado I, Jirik F, Beutler B. Expression of a TNF inhibitor in transgenic mice. Journal of Immunology. November 1993, 151 (10): 5699–5703. PMID 7693816. S2CID 10859938. doi:10.4049/jimmunol.151.10.5699.
- ^ U.S. Patent number: 5,447,851
- ^ Arthritis Drug Effective for Depression in Psoriasis Sufferers. [2008-01-10]. (原始内容存档于2007-10-20).
- ^ Braun J, McHugh N, Singh A, Wajdula JS, Sato R. Improvement in patient-reported outcomes for patients with ankylosing spondylitis treated with etanercept 50 mg once-weekly and 25 mg twice-weekly. Rheumatology. June 2007, 46 (6): 999–1004. PMID 17389658. doi:10.1093/rheumatology/kem069 .
- ^ World Health Organization. World Health Organization model list of essential medicines: 21st list 2019. Geneva: World Health Organization. 2019. hdl:10665/325771 . WHO/MVP/EMP/IAU/2019.06. License: CC BY-NC-SA 3.0 IGO.
- ^ Approval of Etanercept for treatment of rheumatoid arthritis (PDF) (Letter). Letter to Sally Gould. U.S. Food and Drug Administration (FDA). 1998-11-02 [2015-04-14]. (原始内容存档 (PDF)于2015-09-24).
- ^ Approval of Etanercept for treatment of polyarticular course juvenile rheumatoid arthritis (JRA) (PDF) (Letter). Letter to Sally Gould. U.S. Food and Drug Administration (FDA). 1999-05-27 [2015-04-14]. (原始内容存档 (PDF)于2015-09-24).
- ^ Approval of Etanercept for treatment of psoriatic arthritis (Letter). Letter to Sally Gould. U.S. Food and Drug Administration (FDA). 2002-01-15 [2015-04-14]. (原始内容存档于2021-01-22).
- ^ Approval of Etanercept for treatment of ankylosing spondylitis (PDF) (Letter). Letter to Douglas Hunt. U.S. Food and Drug Administration (FDA). 2003-07-24 [2015-04-14]. (原始内容存档 (PDF)于2021-01-22).
- ^ Maxwell LJ, Zochling J, Boonen A, Singh JA, Veras MM, Tanjong Ghogomu E, et al. TNF-alpha inhibitors for ankylosing spondylitis. The Cochrane Database of Systematic Reviews. April 2015, 4 (4): CD005468. PMID 25887212. doi:10.1002/14651858.CD005468.pub2.
- ^ Approval of Etanercept for treatment of moderate to severe plaque psoriasis (PDF) (Letter). Letter to Douglas Hunt. U.S. Food and Drug Administration (FDA). 2004-04-30 [2015-04-14]. (原始内容存档 (PDF)于2021-01-06).
- ^ New hope for survivors of stroke and traumatic brain injury. Springer Select. 2012-10-31 [2018-11-17]. (原始内容存档于2021-06-25).
- ^ US 8900583,Tobinick EL,“Methods for treatment of brain injury utilizing biologics”,发表于2014-12-02
- ^ Another Free Speech Win In Libel Lawsuit Disguised As A Trademark Complaint. Above the Law. 2017-02-24 [2022-06-27]. (原始内容存档于2023-08-31) (美国英语).
- ^ Practice Advisory: Etanercept for Poststroke Disability (pdf). American Academy of Neurology. 2016-06-06 [2024-01-11]. (原始内容存档于2023-01-08).
- ^ Wyeth and Amgen heighten warning of life-threatening infections on skin drug Enbrel. [2008-05-02]. (原始内容存档于2008-05-05).
- ^ Safety Update on TNF- α Antagonists: Infliximab and Etanercept (PDF). U.S. Food and Drug Administration (FDA): 13–14. [2013-12-20]. (原始内容 (PDF)存档于2015-09-24).
- ^ Kim PJ, Lansang RP, Vender R. A Systematic Review and Meta-Analysis of Injection Site Reactions in Randomized-Controlled Trials of Biologic Injections. Journal of Cutaneous Medicine and Surgery. July 2023, 27 (4): 358–367. PMC 10486173 . PMID 37533141. doi:10.1177/12034754231188444.
- ^ Zalevsky J, Secher T, Ezhevsky SA, Janot L, Steed PM, O'Brien C, et al. Dominant-negative inhibitors of soluble TNF attenuate experimental arthritis without suppressing innate immunity to infection. Journal of Immunology. August 2007, 179 (3): 1872–1883. PMID 17641054. doi:10.4049/jimmunol.179.3.1872 .
- ^ Madhusudan S, Muthuramalingam SR, Braybrooke JP, Wilner S, Kaur K, Han C, et al. Study of etanercept, a tumor necrosis factor-alpha inhibitor, in recurrent ovarian cancer. Journal of Clinical Oncology. September 2005, 23 (25): 5950–5959. PMID 16135466. doi:10.1200/JCO.2005.04.127.
- ^ 36.0 36.1 Smola MG, Soyer HP, Scharnagl E. Surgical treatment of dermatofibrosarcoma protuberans. A retrospective study of 20 cases with review of literature. European Journal of Surgical Oncology. October 1991, 17 (5): 447–453. PMID 1936291.
- ^ Houel S, Hilliard M, Yu YQ, McLoughlin N, Martin SM, Rudd PM, et al. N- and O-glycosylation analysis of etanercept using liquid chromatography and quadrupole time-of-flight mass spectrometry equipped with electron-transfer dissociation functionality. Analytical Chemistry. January 2014, 86 (1): 576–584. PMID 24308717. doi:10.1021/ac402726h.
- ^ Mukai Y, Nakamura T, Yoshikawa M, Yoshioka Y, Tsunoda S, Nakagawa S, et al. Solution of the structure of the TNF-TNFR2 complex. Science Signaling. November 2010, 3 (148): ra83. PMID 21081755. S2CID 24226117. doi:10.1126/scisignal.2000954.
- ^ Lamanna WC, Mayer RE, Rupprechter A, Fuchs M, Higel F, Fritsch C, et al. The structure-function relationship of disulfide bonds in etanercept. Scientific Reports. June 2017, 7 (1): 3951. Bibcode:2017NatSR...7.3951L. PMC 5479810 . PMID 28638112. doi:10.1038/s41598-017-04320-5.
- ^ Norman P. Enbrel and etanercept biosimilars: a tale of two patent systems. Pharmaceutical Patent Analyst. January 2017, 6 (1): 5–7. PMID 28201948. doi:10.4155/ppa-2016-0043.
- ^ Gardner J. A three-decade monopoly: How Amgen built a patent thicket around its top-selling drug. 2021-11-01 [2024-01-11]. (原始内容存档于2024-06-03).
- ^ Kowalczyk L. Lucrative Licensing Deals With Drug, Biotech Firms Are Raising Ethics Issues For Hospitals. 2002-03-24 [2024-01-11]. (原始内容存档于2023-10-02).
- ^ Etanercept Product Approval Information - Licensing Action 12/2/98. U.S. Food and Drug Administration (FDA). 2016-04-01 [2020-06-04]. (原始内容存档于2017-01-18).
- ^ "What's behind the whopping price tags on the newest generation of drugs: (页面存档备份,存于互联网档案馆) The story behind the production of Enbrel, Amgen's popular rheumatoid arthritis drug, provides insights as to why bioengineered drugs are so expensive." Carol M. Ostrom, Seattle Times, 2008-08-18
- ^ 45.0 45.1 45.2 Pollock A. Amgen's New Enbrel Patent May Undercut Health Care Plan. The New York Times. 2011-11-23 [2023-03-10]. (原始内容存档于2021-07-25).
- ^ "Co-pay hike a painful reality; Miracle drug monthly cost jumps from $42 to $600" Archive.is的存档,存档日期2013-01-18, Margery Eagan, Boston Herald, 2011-11-03
- ^ 47.0 47.1 47.2 47.3 2013 Comparative Price Report (PDF). International Federation of Health Plans. [2017-11-24]. (原始内容 (PDF)存档于2017-10-22).
- ^ Portions of the 2010 Financial Report. Sec.gov. [2019-06-05]. (原始内容存档于2019-06-10).
- ^ Patent Terms Extended Under 35 USC §156. [2009-12-09]. (原始内容存档于2010-02-24).
- ^ New Amgen Enbrel patent could block biosimilars until 2028. 2011-11-25 [2019-07-14]. (原始内容存档于2019-07-14).
- ^ Kaldre I. The Future of Generic Biologics: Should the United States "Follow-On" the European Pathway?. www.law.duke.edu. 2008 [2019-06-05]. (原始内容存档于2021-08-28).
- ^ Kaldre I. The Future of Generic Biologics: Should the United States "Follow-On" the European Pathway?. www.law.duke.edu. 2008 [2019-06-05]. (原始内容存档于2021-08-28).
- ^ Indian firm Cipla has announced the launch of its etanercept product in India.. S&P Global Market Intelligence. 2013-04-18 [2023-12-28]. (原始内容存档于2023-12-28).
- ^ Benepali EPAR. European Medicines Agency (EMA). 2018-09-17 [2020-04-02]. (原始内容存档于2019-12-30).
- ^ Lifmior EPAR. European Medicines Agency (EMA). 2018-09-17 [2 April 2020]. (原始内容存档于2020-11-29).
- ^ Public statement on Lifmior: Withdrawal of the marketing authorisation in the European Union (PDF). [2020-04-02]. (原始内容存档 (PDF)于2021-08-28).
- ^ Erelzi EPAR. European Medicines Agency (EMA). 2018-09-17 [2020-04-02]. (原始内容存档于2019-12-30).
- ^ Japanese approval for Lupin's etanercept biosimilar. [2024-01-11]. (原始内容存档于2023-12-28).
- ^ AusPAR: Etanercept. Therapeutic Goods Administration (TGA). 2021-02-25 [2021-06-12]. (原始内容存档于2021-06-13).
外部链接
编辑- Etanercept. Drug Information Portal. U.S. National Library of Medicine.