细胞色素P450
此条目需要扩充。 (2012年8月29日) |
细胞色素P450[1](英语:cytochrome P450,缩写 CYP)是包含血基质(heme)作为辅因子的一个庞大的酶超家族,具单加氧酶功能[2][3][4]。在哺乳动物中,这些蛋白质氧化类固醇、脂肪酸和异生物质(外源化学物),对多种化合物的清除,以及激素的合成和分解都很重要。在植物中,这些蛋白质对于防御性化合物、脂肪酸和激素的生物合成很重要[3]。
CYP酶已在所有生命界中被发现:动物,植物,真菌,原生生物,细菌和古菌以及病毒[5]。 但是,它们并不是无处不在。 例如,在大肠杆菌中尚未发现它们[4][6] 。 已知有超过50,000种不同的CYP蛋白[7]。
CYP通常是电子转移链中的末端氧化酶,大致可归类为含P450的系统(P450-containing systems)。 术语“ P450”是从处于还原状态并与一氧化碳络合的酶的最大特征吸收波长(450 nm)处的分光光度的峰值而得名P450。 大多数CYP都需要蛋白质伴侣来传递一个或多个电子以还原铁(并且最终还原分子氧)。
大多数细胞色素P450酶的功能是催化氧化有机化合物。细胞色素P450的受质包括有:如脂质与类固醇激素的代谢中间产物,亦有药物与其他毒性化学物质等非生物物质。细胞色素P450类是涉及肝脏药物代谢与生物激活作用的主要酶类,约占到各种代谢反应总数的75%。
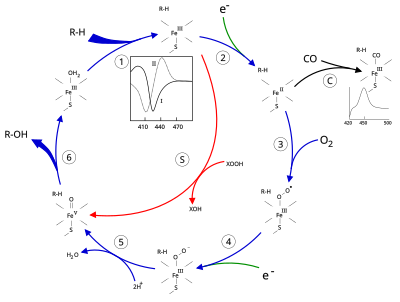
由细胞色素P450催化的最常见反应就是单加氧酶反应,例如将氧气中的一个氧原子插入到有机底物(以RH表示)中,而另一个氧原子被还原形成水:
RH + O2 + 2H+ + 2e– → ROH + H2O

酶活检测
编辑混合探针底物法
编辑该方法可以通过检测非那西丁 O- 脱乙基( CYP1A2) 、 甲苯磺丁脲甲基羟基化( CYP2C9) 、 奥美拉唑 5- 羟基化(CYP2C19) 、 右美沙芬 O- 脱甲基化( CYP2D6) 和咪达唑仑 1'- 羟基化( CYP3A4) 的反应产物确定细胞色素P450 酶的活性。[9]
抑制剂
编辑抑制剂强度分级规则
编辑细胞色素P450 酶的抑制剂强度分级规则[10]如下:
- IC50 <1 μmol·L-1为强抑制剂
- 1μmol·L-1< IC50 <10μmol·L-1 为中等强度抑制剂
- 10 μmol·L-1< IC50 <100 μmol·L-1 为弱抑制剂
- IC50 >100 μmol·L-1 ,在临床上产生明显酶抑制作用的可能性较小
相关抑制剂
编辑参见 CYP1A2、CYP2C9、CYP2C19、CYP2D6、 CYP3A4。
参见
编辑- 类固醇生成酶
- 类固醇生成抑制剂
- 羊毛甾醇14α-脱甲基酶(Lanosterol 14 alpha-demethylase)
- 含P450的系统(P450-containing systems)
参考文献
编辑- ^ 汉语推荐使用规范名词,“细胞色素P450/cytochrome P450/一类以还原态与CO结合后在波长450nm处有吸收峰的含血红素的单链蛋白质”[1] (页面存档备份,存于互联网档案馆),全国科学技术名词审定委员会
- ^ Gonzalez FJ, Gelboin HV. Human cytochromes P450: evolution and cDNA-directed expression. Environmental Health Perspectives. November 1992, 98: 81–5. PMC 1519618 . PMID 1486867. doi:10.1289/ehp.929881.
- ^ 3.0 3.1 Cytochrome P450. InterPro. [2020-06-07]. (原始内容存档于2013-05-14).
- ^ 4.0 4.1 Danielson PB. The cytochrome P450 superfamily: biochemistry, evolution and drug metabolism in humans. Current Drug Metabolism. December 2002, 3 (6): 561–97. PMID 12369887. doi:10.2174/1389200023337054.
- ^ Lamb DC, Lei L, Warrilow AG, Lepesheva GI, Mullins JG, Waterman MR, Kelly SL. The first virally encoded cytochrome p450. Journal of Virology. August 2009, 83 (16): 8266–9. PMC 2715754 . PMID 19515774. doi:10.1128/JVI.00289-09.
- ^ Sigel R, Sigel A, Sigel H. The Ubiquitous Roles of Cytochrome P450 Proteins: Metal Ions in Life Sciences. New York: Wiley. 2007. ISBN 978-0-470-01672-5.
- ^ Nelson D. Cytochrome P450 Homepage. Human Genomics (University of Tennessee). 2009, 4 (1): 59–65 [2014-11-13]. PMC 3500189 . PMID 19951895. doi:10.1186/1479-7364-4-1-59. (原始内容存档于2010-06-27).
- ^ Häggström, Mikael; Richfield, David. Diagram of the pathways of human steroidogenesis. WikiJournal of Medicine. 2014, 1 (1). ISSN 2002-4436. doi:10.15347/wjm/2014.005 .
- ^ 郭喻,汪晖. 人细胞色素 P450 同工酶探针底物特异性的研究进展[J]. 中国药理学通报, 2007, 23( 7) : 851 -4.
- ^ Parmentier Y,Bossant M J,Bertrand M,et al. In vitro studies of drug metabolism[M]/ / Testa B,van de Waterbeemd H. Comprehensive Medicinal Chemistry Ⅱ - ADME- Tox Approaches. Beijing:Science Press, 2007: 246.
外部链接
编辑- Degtyarenko K. Directory of P450-containing Systems. International Centre for Genetic Engineering and Biotechnology. 2009-01-09 [2009-02-10]. (原始内容存档于2016-07-16).
- Estabrook R. A passion for P450s (remembrances of the early history of research on cytochrome P450). Drug Metab Dispos. 2003, 31 (12): 1461–73. PMID 14625342. doi:10.1124/dmd.31.12.1461.
- Feyereisen R. The Insect P450 Site. Institut National de la Recherche Agronomique. 2005-12-19 [2009-02-10]. (原始内容存档于2014-05-30).
- Flockhart DA. Cytochrome P450 drug interaction table. Indiana University-Purdue University Indianapolis. 2007 [2009-02-10]. (原始内容存档于2007-08-30).
- Fowler L, Mercer A. Cytochrome P450 Animated Tutorial. School of Pharmacy, London. [2009-02-10]. (原始内容存档于2016-05-17).
- Preissner S. Cytochrome P450 database. Nucleic Acids Research. 2010. (原始内容存档于2011-11-03).
- Sim SC. Human Cytochrome P450 (CYP) Allele Nomenclature Committee. Karolinska Institutet. 2008-09-04 [2009-02-10]. (原始内容存档于2009-02-08).
- Hazai E. Cytochrome P450 enzyme-substrate selectivity prediction. 2012-02-12. (原始内容存档于2011-02-15).
- Performance of P450 inhibition Studies (页面存档备份,存于互联网档案馆) The performance of in vitro cytochrome P450 inhibition studies studies including analysis of the data.
- DDI Regulatory Guidance (页面存档备份,存于互联网档案馆) Request a guide to drug-drug interaction regulatory recommendations.
- Expanding the toolbox of cytochrome P450s through enzyme engineering (页面存档备份,存于互联网档案馆) Video by the Turner Group, University of Manchester, UK
