过氧化氢
此条目需要补充更多来源。 (2012年9月10日) |
过氧化氢,分子式H₂O₂,是除水外的另一种氢的氧化物。比水稍黏,化学性质不稳定,一般以30%或60%的水溶液形式存放,其水溶液俗称双氧水。过氧化氢氧化力很强,且为弱酸。
| 过氧化氢 | |||
|---|---|---|---|
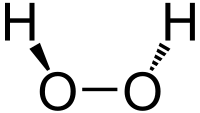
| |||
| |||
| IUPAC名 hydrogen peroxide | |||
| 别名 | 双氧水 二氧烷 氧烷基 过羟酸 0-羟醇 | ||
| 识别 | |||
| CAS号 | 7722-84-1 | ||
| PubChem | 784 | ||
| SMILES |
| ||
| RTECS | MX0900000 | ||
| 性质 | |||
| 化学式 | H2O2 | ||
| 摩尔质量 | 34.0147 g·mol⁻¹ | ||
| 外观 | 淡蓝色液体 溶液无色 | ||
| 密度 | 1.463 g/cm3 (液) | ||
| 熔点 | −0.43 °C(31.23 °F;272.72 K) | ||
| 沸点 | 150.2 °C(302.4 °F;423.3 K) | ||
| 溶解性(水) | 混溶 | ||
| pKa | 11.65 | ||
| 黏度 | 1.245P,当室温为20 °C(68 °F;293 K) | ||
| 偶极矩 | 2.26D | ||
| 危险性 | |||
| 警示术语 | R:R5-R8-R20-R22-R35 | ||
| 安全术语 | S:S1/2-S17-S26-S28-S36-S37-S39-S45 | ||
| MSDS | 30%过氧化氢—MSDS 60%过氧化氢—MSDS | ||
| 主要危害 | 氧化性、腐蚀性 | ||
| NFPA 704 | |||
| 闪点 | 不可燃 | ||
| 致死量或浓度: | |||
LD50(中位剂量)
|
1518 mg/kg | ||
| 相关物质 | |||
| 相关化学品 | 水、臭氧、肼 硫氧化氢、二硫化氢、多硫化氢 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
性质
编辑纯过氧化氢是淡蓝粘稠液体,熔点−0.43 °C(272.72 K),沸点150.2 °C(423.3 K)。凝固点时固体密度每立方厘米1.71克,密度随温度升高而降低。其缔合度比水大,故介电系数和沸点比水高。纯过氧化氢甚稳定,但加热到153 °C(426 K)便猛烈分解为水和氧气。
- H2O2 ↔ H++HO2- Ka1=2.4×10-12
- HO2- ↔ H++O22- Ka2≈10-25
过氧化氢与过量氢氧化钠反应生成过氧化钠和水;与氢氧化钡反应生成过氧化钡。
过氧化氢分子为椅型结构,左图为气态时的结构,右图为固态晶体时的结构:
催化剂
编辑生物体内过氧化氢酶(Catalase)可催化双氧水分解,使其释放出氧气,转化为对有机体无毒的水:
发现
编辑1818年,L.J.Thenard发现水系无机物、有机物在自动氧化时,或者在生物体内呼吸氧气时,在生成水之前会生成过氧化氢。
制备
编辑1950年代以前采用电解法制备过氧化氢,电解硫酸氢盐溶液(如硫酸氢铵、硫酸氢钾)得到过二硫酸盐[1],再加入硫酸[2]得到过氧化氢。
反应
编辑| 氧化剂 | 氧化电位,伏 |
|---|---|
| 氟气 | 3.0 |
| 羟基自由基 | 2.8 |
| 臭氧 | 2.1 |
| 过氧化氢 | 1.8 |
| 高锰酸钾 | 1.7 |
| 二氧化氯 | 1.5 |
| 氯气 | 1.4 |
过氧化氢是非常强的氧化剂,它和其他氧化剂的标准电极电势值列在右面,值越高代表氧化性越强:
分解
编辑该反应在热力学自发:ΔHo为−98.2 kJ·mol−1,ΔGo为−119.2 kJ·mol−1,ΔS为70.5 J·mol−1·K−1。重金属离子Fe2+、Mn2+、Cu2+等可催化过氧化氢分解。它们在酸溶液中的电势介于过氧化氢的电势(0.694至1.76伏)之间,如Fe3+,认为过氧化氢把Fe3+还原为Fe2+,而本身氧化成氧气,过氧化氢又氧化产生的Fe2+为Fe3+,过氧化氢还原成水。过氧化氢在酸性和中性介质中甚稳定,在碱性介质易分解。过氧化氢用波长320至380nm的光照射会加速分解,应盛于棕色瓶并放在阴凉处。无水或浓缩过氧化氢必须在无尘、无金属杂质等环境处理,以防爆炸。H2O2与Fe2+的混合溶液称为芬顿试剂(Fenton)。Fe2+、Ti3+等的离子催化过氧化氢分解生成自由基中间体HO·(羟基自由基)和HOO·。一般使用的双氧水都会有一定量的稳定剂以减慢过氧化氢分解,常用稳定剂包括锡酸钠、焦磷酸钠、8-羟基喹啉和有机亚磷酸酯。[7]
氧化还原
编辑过氧化氢可在水溶液中氧化或还原很多无机离子,作还原剂时产物为氧,作氧化剂时产物为水;如酸性溶液中,过氧化氢可将Fe2+氧化为Fe3+:
过氧化氢可氧化亚硫酸根(SO2−
3)为硫酸根(SO2−
4)。高锰酸钾在酸性溶液会还原为Mn2+;标准电极电势显示,反应在不同pH的方向可能不同,如碱性溶液中,过氧化氢会将锰II氧化为锰IV,以二氧化锰形式生成。
过氧化氢还原次氯酸钠的反应可用于实验室制备氧气:
有机化学常用过氧化氢作氧化剂,可将硫醚氧化为亚砜;将甲基苯基硫醚氧化为甲基苯基亚砜,以甲醇作溶剂或三氯化钛催化,产率为99%:
碱性过氧化氢溶液可用于环氧化富电子烯烃(如丙烯酸),以及在硼氢化-氧化反应第二步中氧化烷基硼至醇。
优点是氧化力强,还原产物为水,不引入杂质且不污染环境,是用途十分广泛的氧化剂。
生成过氧化物
编辑过氧化氢与很多无机或有机化合物反应时,过氧链保留并转移到另一分子,生成新的过氧化物:
- 过氧化氢可生成很多含有O22−过氧离子的无机盐类,较重要的有过氧化钠、过氧化镁和过氧化钙
- 过氧化氢在低温与酸性铬酸或重铬酸盐溶液反应生成不稳定蓝色过氧化铬CrO(O2)2,可用乙醚或戊醇萃取,过氧化铬在水溶液会与过氧化氢继续反应,蓝色迅速消失,得到氧气和铬离子。这反应可用来检验过氧化氢和铬酸根或重铬酸根。
- 4H2O2+Cr2O72-+2H+ → 2CrO5+5H2O
- 7H2O2+2CrO5+6H+ → 7O2↑+2Cr3++10H2O
- Na₂B₄O₇+4H₂O₂+2NaOH → 2Na₂B₂O₄(OH)₄+H₂O
碱性
编辑与水相比,过氧化氢的碱性要弱得多,只有与很强的酸反应才会生成加合物。超强酸氟锑酸(HF/SbF5)可质子化过氧化氢,生成含[H3O2]+离子的产物。
用途
编辑稀(如3%)过氧化氢主要用于杀菌及外用的医疗用途,如消毒伤口。检验血液的最佳比率:6%双氧水加0.005%亚甲蓝。过氧化氢甚易化解,以界面活化剂等混合过氧化氢(称为加速过氧化氢Accelerated Hydrogen Peroxide,简称AHP)﹐除加强杀菌消毒的效果,也可用作兼具杀菌效能的清洁剂。
较浓者(浓于10%),则用于纺织品、皮革、纸张、木材制造工业,作为漂白及去味剂。过氧化氢也是染发剂的成分之一,还用作合成有机原料(邻苯二酚)的材料,医药、金属表面处理剂,聚合引发剂等。还可用作火箭推进剂。
很多颜料、涂料含有铅白。使用铅白的油画、壁画等艺术品长时间暴露在空气中,与硫化氢作用生成硫化铅而变暗发黑,用过氧化氢涂刷会生成白色的硫酸铅从而复原之。
- PbS+4H2O2 → PbSO4+4H2O
危险行为
编辑历史事件
编辑参见
编辑参考文献
编辑- ^ 电解:KHSO4 → K2S2O8+ H2↑
- ^ K2S2O8 + H2SO4 = K2SO4 + H2S2O8使过二硫酸水解,水解过程分为两步:H2S2O8 + H2O = H2SO5 + H2SO4; H2SO5 + H2O = H2SO4 + H2O2
- ^ 存档副本. [2023-01-06]. (原始内容存档于2022-12-30).
- ^ 存档副本. [2023-01-06]. (原始内容存档于2023-01-05).
- ^ Perry, Samuel C.; Pangotra, Dhananjai; Vieira, Luciana; Csepei, Lénárd-István; Sieber, Volker; Wang, Ling; Ponce de León, Carlos; Walsh, Frank C. Electrochemical synthesis of hydrogen peroxide from water and oxygen. Nature Reviews Chemistry. 2019-07, 3 (7): 442–458 [2019-12-18]. ISSN 2397-3358. doi:10.1038/s41570-019-0110-6. (原始内容存档于2020-06-13) (英语).
- ^ Gyenge, E.L.; Oloman, C.W. Electrosynthesis of hydrogen peroxide in acidic solutions by mediated oxygen reduction in a three-phase (aqueous/organic/gaseous) system Part I: Emulsion structure, electrode kinetics and batch electrolysis. Journal of Applied Electrochemistry. 2003-08-01, 33 (8): 655–663 [2019-12-18]. ISSN 1572-8838. doi:10.1023/A:1025082709953. (原始内容存档于2022-05-12) (英语).
- ^ Hydrogen Peroxide Technical Library | USP Technologies. www.h2o2.com. [2021-01-07]. (原始内容存档于2021-04-26).


